disclaimer &
медицина
иммунология
половые стероид...
аватары
обо мне
визитки &
css &
клипарт
лит-ра
lola rennt
ссылки &
отметиться
дать денег
гостевая книга
ВИДЫ ИССЛЕДОВАНИЯ
Гендерные различия в иммунной системе мужчин и женщин, проявляющиеся не только в периоды гормональной перестройки, но и в другие периоды жизни, обусловливают актуальность освещения влияния половых стероидов на иммунную систему. По данным литературы (Anna Oldenhave, Coen Netelenbos, 1994; Deborah J. Anderson, 2000), пик заболеваемости аутоиммунной патологией у женщин приходится на периоды дисгормональных изменений (табл. 1) — это либо пубертатный период, либо ранний послеродовый, либо, что чаще всего, климактерический период (возраст 40-55 лет).
Таблица 1 Соотношение распространенности аутоиммунных заболеваний у женщин и мужчин (Deborah J. Anderson, 2000; Druckmann R., 2001).
Заболевания | Возраст дебюта заболевания (годы) | Соотношение у женщин / мужчин |
| Частые (> 1:1000) | ||
| Ревматоидный артрит | 35-50 |
3:1 |
| Пернициозная анемия | 60-70 |
1,5:1 |
| Болезнь Грейвса | 20-40 |
6:1 |
| Тиреоидит Хашимото | 40-60 |
40:1 |
| Сахарный диабет 1 типа | 12-20 |
1:1 |
| Нередко встречающиеся (< 1:1000) | ||
| Системная красная волчанка | 20-40 |
9:1 |
| Синдром Шегрена | 10-25 |
9:1 |
| Хронический активный гепатит | 50-60 |
3:1 |
| Редко встречающиеся (< 1:10000) | ||
| Склеродермия | 45-65 |
3:1 |
| Полимиозит | 45-65 |
2:1 |
| Первичный билиарный цирроз печени | >35 |
9:1 |
| Аутоиммунная гемолитическая анемия | >60 |
1,5:1 |
| Иммунная тромбоцитопеническая пурпура | 20-40 |
4:1 |
| Миастения gravis | 20-30 |
3:1 |
Особенно выраженная тендерная разница, отмеченная в отношении аутоиммунных заболеваний, которые дебютируют в возрасте старше 35 лет, дает основание трактовать их развитие не столько как результат инволюции иммунной системы с возрастом, сколько как следствие неадекватной реакции иммунного статуса на инволюцию репродуктивной системы у женщин.
Следует отметить, что согласно данным C.J. Grossman et al. (1994) у женщин как гуморальная, так и клеточная составляющие иммунного ответа более выражены, чем у мужчин (длительнее продолжительность иммунного ответа, более низкий порог для его развития, а также выше пик антител). Это подтверждает существование феномена, называемого в литературе иммунологическим половым диморфизмом (Grossman С.J. et al., 1994).
Он состоит, прежде всего, в более выраженной реакции женского организма на экзогенные инвазивные факторы — инфекция, чужеродное вмешательство и др. (Grossman C.J. et al., 1994; Druckmann R., 2001).
Так, уровень IgM выше у женщин, чем у мужчин, при этом уровни IgG практически не отличаются (Grossman C.J. et al., 1994; Druckmann R., 2001).
Кроме того, у женщин обнаружен более высокий уровень Т-хелперных и меньшее содержание Т-супрессорных клеток, то есть более выраженная активация В-системы иммунитета, что и объясняет вышеупомянутые различия в содержании антител (Grossman C.J. et al., 1994; Druckmann R., 2001).
При этом женщины демонстрируют более сильную реакцию на трансплантаты, у женщин более активна клеточно-опосредованная иммунная реакция на вирусные инфекции (Grossman C.J. et al., 1994; Druckmann R., 2001).
Таким образом, на все экзогенные факторы, которые включаются в той или иной мере в жизнедеятельность организма, женский организм реагирует более остро, чем мужской. Это прослеживается как на уровне системного иммунитета, так и на уровне секреторного (местного). Так, доказано, что у женщин уровни Ig А в моче и в бронхиальных смывах выше, чем у мужчин (Grossman C.J. et al, 1994; Druckmann R., 2001).
При беременности иммунная система женщины настраивается еще более агрессивно на внешние раздражители (у беременных женщин выше уровни антител к Escherichia coli, чем у небеременных) и при этом формирует иммунорезистентность к плоду, который согласно современным концепциям рассматривается как аллотрансплантат (Grossman C.J. et al., 1994; Druckmann R., 2001).
С другой стороны, у женщин по сравнению с мужчинами больше патологических аутоантител, что, соответственно, и объясняет более частое развитие у них аутоиммунной патологии, которая дебютирует в периоды дисгормональных изменений, особенно с началом инволюции репродуктивной системы (Deborah J. Anderson, 2000; Druckmann R., 2001).
В ходе освещения данного вопроса считаем целесообразным представить структуру и эволюцию иммунной системы.
Так, органы иммунной системы,обеспечивающие приобретенный иммунитет, принято (Дранник Г.Н., 1999) подразделять на две группы: центральные (первичные) и периферические (вторичные).
К центральным органам иммунной системы относятся вилочковая железа (тимус) и костный мозг; к периферическим — селезенка, лимфатические узлы, лимфоглоточное кольцо, лимфоидная ткань слизистых оболочек, а также лимфоидные клетки, циркулирующие в периферической крови (Дранник Г.Н., 1999).
Органы и клетки иммунной системы вместе составляют единый диффузный орган (масса его около 1,5-2 кг, а количество лимфоидных клеток колеблется в пределах 1-2 x 1012), объединенный общей функцией (Дранник Г.Н., 1999).
Основная функция иммунной системы — иммунный надзор, т. е. защита организма от экзо- или эндогенных веществ, несущих признаки генетически чужеродной информации (Дранник Г.Н., 1999).
Все клетки иммунной системы происходят из единого предшественника — гемопоэтической полипотентной стволовой клетки (рис. 1).
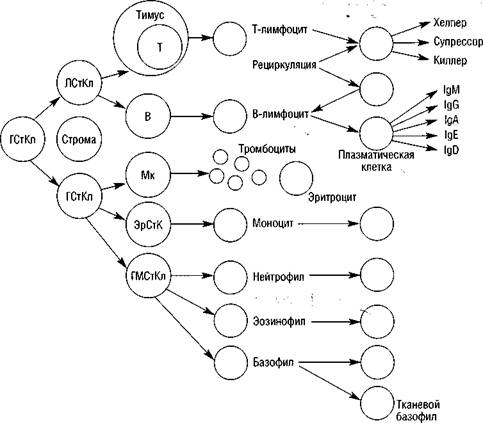
Рисунок 1. Основные сведения о структуре иммунной системы. Примечание: ЛСтКл — лимфоидная стволовая клетка; ГСтКл — гемопоэтическая стволовая клетка; ЭрСтКл — эритроидная стволовая клетка; ГМСтКл — гранулоцитарно-моноцитарная стволовая клетка; Мк — мегакариоцитарная стволовая клетка.
Гемопоэтическая полипотентная стволовая клетка (ГСтКл), в свою очередь, происходит из эмбриональной стволовой клетки и обнаруживается у эмбриона вначале в желточном мешке, а затем в эмбриональной печени. После рождения местом ее пребывания становится костный мозг. Гемопоэтическая полипотентная стволовая клетка дает начало лимфоидной стволовой клетке, из которой образуются Т- и В-лимфоциты, а также миелоидной стволовой клетке, дающей начало тромбоцитам, гранулоцитам и моноцитам (Дранник Г.Н., 1999).
Гемопоэтическая полипотентная стволовая клетка располагается в прикостной части костного мозга в тесном контакте со специализированной стромой. Контакты стволовой клетки с клетками стромы и локальная продукция цитокинов являются теми сигналами, которые регулируют пролиферацию и дальнейшую дифференцировку стволовой клетки (Дранник Г.Н., 1999).
Специальными органами, в которых происходит дифференцировка гемопоэтических стволовых клеток, служат: для Т-лимфоцитов — тимус, для В-лимфоцитов в эмбриональном периоде — печень, во взрослом организме — костный мозг (Дранник Г.Н., 1999).
Процесс формирования элементов иммунной системы происходит в три этапа (табл. 2) и на каждом этапе определяется состоянием гормонального гомеостаза в определенный период (Дранник Г.Н., 1999; Grossman C.J. et al., 1994).
Таблица 2. Этапы дифференцировки Т- и В-лимфоцитов (Дранник Г.Н., 1999).
|
1 этап |
II этап |
III этап |
Т-лимфоциты |
Протекает в костном мозге. Под действием дифференцированного сигнала на поверхности лимфоидной стволовой клетки экспрессируется рецептор ГП-33 (гликопротеин с молекулярной массой 33 кД) |
Протекает в тимусе. ГП-33 трансформируется в антиген, распознающий рецептор (АГРР). Обеспечивается развитие толерантности к аутоантигенам |
Протекает в тимусе. На поверхности лимфоцитов появляются дифференцировочные рецепторы для различных субпопуляций |
В-лимфоциты |
Протекает в костном мозге. Под действием дифференцированного сигнала на поверхности лимфоидной стволовой клетки экспрессируется суррогатная легкая цепь (L-цепь) IgM |
Протекает в костном мозге. На поверхности В-лимфоцитов экспрессируется молекула Ig M. Обеспечивается развитие толерантности к аутоантигенам |
Протекает в костном мозге. На поверхности появляется IgG |
После антигенной стимуляции различные ступени формирования клонов активизируются и приводят к образованию полных функционально зрелых эффекторных лимфоцитарных субклассов (Дранник Г.Н., 1999).
В соответствии с международной классификацией все основные антигенные маркеры лимфоцитов и других клеток иммунной системы сведены в группы и обозначены как кластеры дифференцировки (CD). Набор различных CD на отдельных клетках (табл. 3) составляет фенотип (поверхностная характеристика).
Таблица 3. Специфические и неспецифические клетки иммунной системы (Aydin Arici et al., 1999).
Клетки |
Функция |
В-лимфоциты |
Предшественники антителпродуцирующих клеток |
Т-лимфоциты |
Распознают и взаимодействуют с антигенами, представленными на чужеродных агентах, существуют различные популяции |
Т-хелперы (CD4+) |
Способствуют делению, дифференциации В-клеток и продукции антител |
Т-цитотоксики (CD8+) |
Повреждают клетки-мишени |
Т-супрессоры |
Угнетают активность других Т- и В-клеток |
Моноциты |
Циркулирующие,неспецифические фагоциты, антигенпрезентирующие клетки |
Макрофаги |
Моноциты, мигрирующие в ткани |
Гранулоциты |
фагоцитарные клетки с коротким сроком жизни (2-3 дня), мигрирующие в ткани под влиянием хемотаксиса |
Естественные киллеры |
Неспецифические, цитотоксические клетки, обладают способностью лизировать различные опухоли или вирусинфицированные клетки |
Адгезионной молекулой для главного комплекса гистосовместимости первого класса является CD8+, которая экспрессируется примерно на одну треть периферических Т-клеток. Субпопуляция СD8+ Т-лимфоцитов включает цитотоксические/супрессорные Т-лимфоциты (Дранник Г.Н., 1999).
Адгезионной молекулой для главного комплекса гистосовместимости второго класса является CD4+, которая экспрессируется на субпопуляции Т-лимфоцитов-хелперов. В свою очередь, Т-лимфоциты-хелперы разделяются (табл. 4) на две субпопуляции первого и второго типов (Th-1 и Th-2), выполняющие разные хелперные функции за счет продукции разных цитокинов (Дранник Г.Н., 1999).
Гуморальное звено иммунной системы представляют собой В-лимфоциты, продолжительность жизни которых колеблется от нескольких дней до многих лет (Дранник Г.Н., 1999).
Как уже упоминалось (Grossman С J. et al., 1994), кроме антигенной стимуляции, факторами, приводящими к активации иммунной системы, являются изменения гормонального гомеостаза (рис. 2).
Таблица 4. Характеристика Т-клеток (Aydin Arici et al., 1999)
Субпопуляция Т-клеток |
Символ |
Специфический |
Класс |
Клетка-мишень |
Функция |
Цитотоксики |
Тс |
CD8 |
1 |
Опухоли, вирус-инфицированные клетки и др. |
Уничтожение незнакомых клеток и клеток с новыми антигенными свойствами |
Хелперы |
Th |
CD4 |
2 |
В-клетки, Тс-клетки |
Секреция интерлейкинов |
Индукторы |
Th |
CD4 |
2 |
В-клетки, Тс-клетки предшественники, макрофаги |
Секреция интерлейкинов |
Супрессоры |
Ts |
CD8 |
2 |
В-клетки, Th-клетки, Тс-клетки |
Угнетение роста клеток |
Клетки гиперчувствительности |
Tdth |
CD4 |
2 |
Клетки Лангерганса, макрофаги, Тс-клетки |
Уменьшение макрофаг-активирующего фактора, фактора угнетения миграции и других цитокинов |
Клетки памяти |
Tm |
CD8 CD4 |
1,2 |
В-клетки, Т-клетки |
Обеспечение |
Так, в последние годы доказано (Grossman C.J. et al., 1994), что именно половые стероидные гормоны влияют на способность зрелых эффекторных клеток к реализации иммунного ответа (рис. 3).
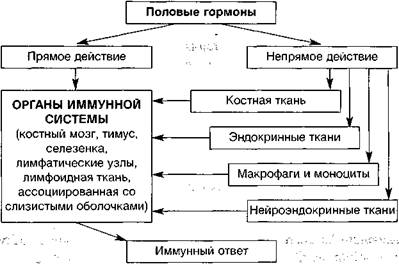
Рисунок 3. Половые стероидные гормоны и иммунный ответ (Druckmann R., 2001).
Прямое воздействие половых стероидных гормонов на органы и ткани иммунной системы обеспечивается рецепторно-опосредованным путем. В настоящее время (Donald P., McDonnell, 2000) отчетливо идентифицируются различные рецепторы как прогестерона (PRA, PRB), так и эстрогенов (ER-ot, ER-P).
В связи с этим определенный интерес представляют сведения о преимущественной локализации подвидов эстрогенных рецепторов в различных органах и тканях, в том числе и иммунной системе, представленные в таблице 7 главы 14 этой книги.
Таблица 7. Экспрессия эстрогенных рецепторов аир в различных органах и системах (из главы 14).
Эстрогенные рецепторы а |
Вентромедиальные и аркуатные ядра гипоталамуса |
Эстрогенные рецепторы р |
Супраоптические и паравентрикулярные ядра гипоталамуса |
Эстрогенные рецепторы ар |
Яичники |
Знание преимущественного размещения рецепторов в различных тканях важно особенно в отношении выбора препарата для лечения эстроген-дефицитных состояний. Так, известно, что 17Р-эстрадиол и эстрадиола валерат действуют в одинаковой степени как на а-, так и на Р-рецепторы эстрогенов. В то же время различные фитоэстрогены 'с разной степенью интенсивности связываются с а- и Р-рецепторами (Donald P., McDonnell, 2000; Michelle P. Warren et al, 2000).
Наличие рецепторов к эстрогенам на ретикулоэпителиальном матриксе тимуса объясняет возможность регуляции функций иммунной системы как непрямым путем — через снижение продукции гормонов тимуса (тимозина, тимопоэтина, тимического гуморального фактора, тимулина) и воздействие на уровень цитокинов, так и прямым путем — через лимфоцитарные стероидные рецепторы (Grossman C.J. et al., 1994).
При этом рецепторы к эстрогенам только в меньшей степени выраженности идентифицированы и на лимфоидных клетках, и на циркулирующих лимфоцитах. Особенно много соответствующих рецепторов на CD8+T-клетках, то есть клетках цитолитической/супрессивной природы (Chernyshov V.P. et al., 2001; Deborah J. Anderson, 2000).
Выявлено, что эстрадиол стимулирует антигенспецифический иммунный ответ, возможно путем угнетения СD8+Т-клеток и, соответственно, активации СD4+Т-клеток, и, впоследствии, регулирует В-клеточную функцию (Chernyshov V.P. et al., 2001; Deborah J. Anderson, 2000).
Кроме того, обнаружено существование как андрогенных, так и эстрогенных рецепторов и на стромальных клетках костного мозга. Это позволяет предположить, что стромальные клетки представляют собой потенциальную мишень для эстрогенной активности (Kincade P.W. et al., 2000).
Так, эстрогены замедляют продукцию лимфоцитов опосредованно через стромальные клетки, вызывая в них синтез субстанций, супрессирующих В-лимфопоэз. Кроме того, сами предшественники В-лимфоцитов также являются прямой мишенью для половых стероидов. Это важно для генетической идентификации факторов транскрипции и других критических молекул, регулируемых эстрогенами (Kincade P.W. et al., 2000).
Высокая афинность эстрогенных рецепторов проявляется не только на лимфоцитах и клетках костного мозга, но и на тимоцитах, макрофагах и эндотелиальных клетках (Grossman C.J. et al, 1994).
Влияние эстрогенов на макрофаги и другие антигенпрезентирующие клетки выражено незначительно, но в то же время отмечается повышение фагоцитарной активности и ингибирование макрофагального интерлейкина (ИЛ-1). Таким образом, макрофаги можно рассматривать как мишень прямого и непрямого действия половых гормонов (Grossman C.J. et al., 1994).
Эстрогенные рецепторы обнаружены также на естественных киллерах, основное свойство которых — цитотоксичность и способность продуцировать цитокины (Дранник Г.Н., 1999; Brunelli R. et al., 1996). Это позволяет предположить помимо прямого опосредованный через иммунную систему путь влияния эстрогенов на опухолевый рост (Brunelli R. et al., 1996). v Эстрогены воздействуют не только, как уже упоминалось, на продукцию гормонов тимуса и цитокинов, но и на активацию мембраносвязывающих рецепторов к тимусным гормонам и цитокинам (Дранник Г.Н., 1999; Brunelli R. et al, 1996).
Цитокины — группа белковых соединений или гликопептидов (табл. 5), которые вырабатываются, в основном, активированными клетками иммунной системы, являются медиаторами межклеточных и межсистемных взаимодействий при иммунном ответе, гемопоэзе, воспалении и неспецифичны по отношению к антигенам (Дранник Г.Н., 1999; Brunelli R. et m., 1996).
Таблица 5. Цитокины, их биологические эффекты и точки приложения (Aydin Arici et a!., 1999).
Цитокины |
Источник |
Клетки-мишени |
Эффект |
ИЛ-1 |
Макрофаги, В-клетки, ЕК |
Т-клетки, В-клетки, макрофаги |
Активация лимфоцитов, стимуляция макрофагов, термогенного эффекта и индукция острой стадии воспаления |
ИЛ-2 |
Т-клетки, ЕК |
В-клетки, Т-клетки, ЕК, макрофаги |
Активация лимфоцитов, макрофагов, стимуляция секреции лимфокинов |
ИЛ-3 |
Т-клетки |
Стволовые клетки |
Пролиферация |
ИЛ-4 |
Т-клетки |
В-клетки, макрофаги |
Пролиферация лимфоцитов, активация макрофагов, влияние на различные классы иммуноглобулинов |
ИЛ-5 |
Т-клетки |
В-клетки, стволовые клетки, эозинофилы |
Пролиферация, дифференциация, включение lg A |
ИЛ-6 |
Многочисленные клетки |
В-клетки, макрофаги |
Пролиферация, стимуляция секреции иммуноглобулинов, индукция острой стадии воспаления |
ИЛ-7 |
Стромальные клетки |
Пре -В-клетки, макрофаги |
Пролиферация |
ИЛ-8 |
Многочисленные клетки |
Нейтрофилы, Т-клетки |
Хемотаксис лейкоцитов |
ИЛ-9 |
Т-клетки |
Th-клетки |
Пролиферация |
ИЛ-10 |
Т-клетки |
Т-клетки |
Угнетение синтеза лимфокинов |
ИЛ-11 |
Стромальные клетки |
Гемопоэтические клетки |
Гемопоэз |
ИЛ-12 |
Макрофаги |
ЕК |
Стимуляция |
ИЛ-13 |
Активированные Т-клетки |
Моноциты, В-клетки |
Пролиферация В-клеток |
ИЛ-14 |
Т-клетки |
В-клетки |
Угнетение синтеза иммуноглобулинов |
ИЛ-15 |
Многочисленные клетки |
Т-клетки |
Пролиферация |
ГМ-КСФ |
Т-клетки, моноциты |
Стволовые клетки, |
Пролиферация, дифференциация |
МХП-1 |
Многочисленные клетки |
Моноциты |
Активация хемотаксиса |
ОНФ |
Макрофаги, Т-клетки, ЕК |
В-клетки |
Рост и дифференциация |
ЛИФ |
Многочисленные клетки |
Клетки-предшественники, эмбриональные клетки, трофобласт |
Пролиферация, дифференциация |
Иф-γ |
Т-клетки, ЕК |
Макрофаги, В-клетки |
Дифференциация |
| Примечание: ИЛ — интерлейкин, ЕК — естественные киллеры, ГМ-КСФ — гранулоцит-макрофаг колониестимулирующий фактор, МХП-1 — моноцит хемотаксический протеин, ОНФ — опухоль-некротизирующий фактор, ЛИФ — лейкоцит-ингибирующий фактор, ИФ-γ — интерферон | |||
Эстрогены влияют на цитокины, обеспечивая:
- альтерацию экспрессии цитокинов на уровне транскрипции и посттранскрипционном этапе;
- модуляцию экспрессии цитокиновых рецепторов;
- модификацию эффекта цитокинов на клетки-мишени (Alan В. MсCruden and William H. Stimson, 1994).
Доказано, что адекватный иммунный ответ обеспечивается определенным гормональным гомеостазом, и любые его изменения приводят, соответственно, к нарушению нормальной иммунологической реактивности. Так, в условиях дефицита эстрогенов, т.е. в менопаузе, значительно снижается соотношение CD4+/CD8+, повышается уровень CDgt, CD3+ и CD?+, происходит повышение активности естественных киллеров, растет количество и активность В-лимфоцитов (Brunelli R. et al., 1996; White H.D. et al., 1997).
Таким образом, обобщая данные о воздействии эстрогенов на иммунный ответ (рис. 4), следует, однако, отметить дозозависимость влияния эстрогенов на Т-, В-лимфоциты и на иммунную систему в целом (Grossman C.J. et al., 1994).
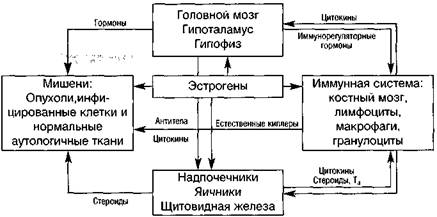
Рисунок 4. Влияние эстрогенов на иммунную систему (Nagy E. et at, 1999).
Так, в высоких концентрациях эстрогены блокируют развитие Т-клеток в вилочковой железе, обеспечивают угнетение Т-цитотоксиков и активацию Т-хелперов, под воздействием которых активируется созревание В-клеток и, следовательно, увеличивается продукция антител в ответ на антигенную стимуляцию (Grossman C.J. et al, 1994).
Низкие дозы эстрогенов обеспечивают так называемое иммуномодулирующее действие, т.е. способствуют восстановлению упомянутых выше дисиммунных нарушений, развивающихся на фоне дефицита эстрогенов (Grossman C.J. et al, 1994).
Так, по данным P.W. Kincade et al. (2000) продукция новых В-лимфоцитов повышается при падении системного уровня эстрогенов ниже нормы и, наоборот, снижается, когда их содержание возрастает. Однако установлено, что увеличивается не вся популяция предшественников В-лимфоцитов, а только лимфоцитов определенной степени развития, т.е. отмечено существование гормонально-чувствительной критической точки дифференциации лимфоцитов в костном мозге (Grossman C.J. et al., 1994; Kincade P.W. et al., 2000).
Это чрезвычайно важно для понимания реакции иммунной системы на применение гормональных контрацептивов, с одной стороны, и препаратов ЗГТ — с другой.
Что касается влияния прогестерона на иммунный ответ, то, известно, что в отличие от эстрогенных рецепторов, лимфоциты не имеют классических прогестероновых рецепторов, но, как и макрофаги, имеют глюкокортикоидные рецепторы. Поэтому принято считать, что влияние прогестерона на иммунную систему осуществляется опосредовано через глюкокортикоидные рецепторы (Grossman C.J. et al., 1994).
Глюкокортикоиды оказывают Т-супрессивный и противовоспалительный эффекты через моноциты, цитокины Т-клеточного генеза, особенно ИЛ-1, опухоленекротизирующий фактор (ОНФ) и ИЛ-2. Прогестерон и ацетилированные прогестагены прегнанового типа активизируют глюкокортикоидные рецепторы и оказывают глюкокортикоидоподобное иммуносупрессивное действие, включая ингибирование Т-клеточной активности, повышение опухолевой индукции и лимфоцитопении (Grossman C.J. et al., 1994).
В то же время в последние годы стало известно, что введение прогестерона при нормальном его метаболизме стимулирует Th1 ответ, тогда как эстрогены его угнетают (Druckmann R., 2001).
На гуморальное звено иммунитета действие прогестерона, как и глюкокортикоидов, носит противоположный характер. Индуцируется секреция Т-хелперами интерлейкинов-4 и 5, что способствует дифференциации В-клеток и синтезу антител. Прогестерон также влияет на воспалительную реакцию путем активации продукции моноцитами ИЛ-1, ОНФ и угнетения синтеза оксида азота (Grossman C.J. et al., 1994).
В то же время отмечено, что при введении прогестерона в эндометрии не происходит увеличение численности ни макрофагов, ни В-клеток, хотя доказано наличие прогестероновых рецепторов на макрофагах, а растет только содержание лейкоцитов и Т-клеток (Druckmann R., 2001).
Исследования, проведенные в последние годы, показали, что в результате предшествующей стимуляции эстрогенами в ретикулоэндотелиальных клетках вилочковой железы синтезируются прогестероновые рецепторы. То есть, прямое адекватное воздействие прогестерона на иммунную систему возможно при условии определенного достаточного уровня эстрогенов (Druckmann R., 2001).
Тогда как эстрогены, как уже упоминалось выше, угнетают клеточный иммунитет, введение прогестерона при нормальном его метаболизме стимулирует реакцию переключения Th1 на Th2. При этом прогестерон, в отличие от эстрогенов, вызывает обратимую деполяризацию естественных киллеров пропорционально времени и концентрации (Druckmann R., 2001).
Регулирующее действие прогестерона на Т-клетки и естественные киллеры обеспечивается путем обратимой блокады потенциало- и кальцийзависимых каналов с последующей деполяризацией мембран (Druckmann R., 2001). Таким образом, в свете современных представлений (Дранник Г.Н., 1999) можно утверждать, что процесс дифференцировки Т-лимфоцитов-хелперов 1- и 2-го типов (Th-1 и Th-2) обеспечивается не только соотношением важнейших регуляторных цитокинов (ИЛ-12, γ-интерферон, ИЛ-10), но и уровнем половых стероидных гормонов (особенно прогестерона) на данный момент (рис. 5).
Что касается действия андрогенов на иммунную систему, то на тимоцитах выявлены также андрогенные рецепторы. Под воздействием дегидроэпиандростерона и андростендиона отмечено преобладание иммуносупрессивных глюкокортикоидоподобных эффектов (Grossman C.J. et al., 1994; Kincade P.W. et al., 2000).
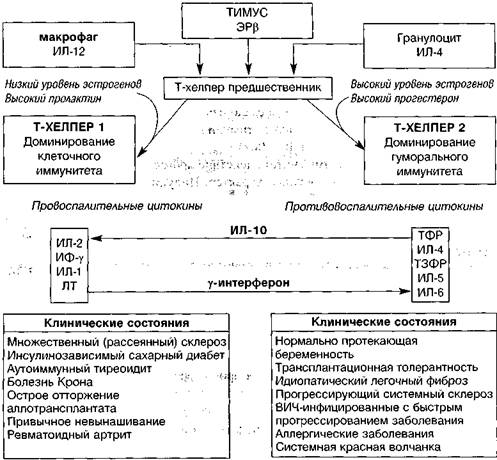
ИФ — интерферон, ЛТ — лейкотриен, ТФР — трансформирующий фактор роста, ТЗФР — тромбоцит-зависимый (тромбоцитарный) фактор роста.
Рисунок 5. Эндокринная регуляция иммунного ответа (Druckmann R., 2001 с изменениями и дополнениями).
Хотя тестостерон не взаимодействует с глюкокортикоидными рецепторами, упомянутые выше андрогены взаимодействуют с ними благодаря высокой степени гомологичности между различными стероидами и их рецепторами (Blum M. et al., 1990; Grossman С J. et al., 1994).
Обобщая вышеизложенное, следует отметить, что все половые стероиды участвуют в регуляции иммунного ответа (Blum M. et al., 1990; Grossman C.J. etal., 1994).
Половые стероиды обладают не только системным воздействием на иммунологическую реактивность, но и оказывают значительное влияние на состояние местного иммунитета, а именно: защитного иммунитета слизистых половых путей (Grossman C.J. et al., 1994; Lemola—Virtanen R. et al., 1997).
По данным литературы иммунная защита слизистой поверхности полового тракта реализуется, в основном, под влиянием яичниковых гормонов (Grossman C.J. et al, 1994; Lemola—Virtanen R. et al, 1997).
Эстрогены способствуют повышению Ig M и повышают экспрессию Ig-рецептора опосредованно через транспорт Ig А и Ig M через эпителий слизистой полового тракта (Milson Г Nilsson L.A. et al., 1991; Molland J.G. et al., 1990).
Кроме этого, эстрогены увеличивают толщину влагалищного эпителия и способствуют секреции муцинов и других важных защитных факторов, таких как компоненты комплементарной системы (С3). На фоне эстрогенной недостаточности развивается дисбактериоз влагалища, проявляющийся снижением лактобактерий и нарастанием количества бактерий фекальной группы (White H.D. et al, 1997).
Таким образом, эстрогены значительно улучшают иммунитет слизистых и, соответственно, обеспечивают защиту от инфекций (Brunelli R. et al., 1996; Grossman C.J. et al., 1994).
За счет прогестерона осуществляются другие иммунные функции. Так, макрофаги, играющие важную роль в местном иммунитете слизистых, особенно чувствительны к эффектам прогестерона (Grossman C.J. et al., 1994).
Секреция неполных цитокинов, включая лейкемий-ингибирующий фактор, гранулоцит/макрофаг-колонийстимулирующий фактор (GM-CSF), ИЛ-1 и трансформирующий фактор роста р (TGH-J3), которые оказывают иммуностимулирующие эффекты, реализуется у женщин в репродуктивном тракте в течение лютеиновой (прогестерон-доминирующей) фазы менструального цикла (Grossman C.J. et al., 1994).
В дополнение к этому популяция естественных киллеров (ЕК) увеличивается в репродуктивном тракте также в лютеиновую фазу. ЕК не имеют прогестероновых рецепторов, т. е. в этом случае реализуется непрямой эффект прогестерона (Дранник Г.Н., 1999; Albrecht A.E. et al, 1996).
Кроме того, прогестерон угнетает индукцию хемокиновых рецепторов на Т-клетках и ингибирует продукцию хемокинов. Хемокины — это важные регуляторы Т-клеточной миграции в тканях и активирования CD8+T-клеток (Дранник Г.Н., 1999; Albrecht A.E. et al., 1996). Этим в определенной степени можно объяснить тот факт, что прогестерон повышает чувствительность к инфекциям, передающимся половым путем. Это происходит, видимо, как в результате упомянутых изменений в местном иммунитете, так и благодаря изменению толщины эпителия на фоне прогестеронового воздействия.
Однако исследования других авторов (Lemola—Virtanen R. et al., 1997) указывают на более высокую чувствительность к хламидийной инфекции именно в пролиферативную (эстрогенную) фазу.
Таким образом, имеющиеся на сегодня достаточно неоднозначные результаты клинических наблюдений подтверждают целесообразность дальнейших исследований по изучению воздействия половых стероидов на иммунный ответ как в клинике, так и в эксперименте.
Так, исследования J. Huber (2001) показали, что вводимый во влагалище прогестерон увеличивал численность клеток Лангерганса в эпителии влагалища у самок грызунов в состоянии течки. 17β-эстрадиол ослаблял представление антигенов и снижал численность клеток Лангерганса во влагалищном эпителии. Таким образом, в присутствии 17β-эстрадиола вероятность выживания аллогенных сперматозоидов во влагалище и возможность оплодотворения повышались. В состоянии же диэструса, которое начиналось после спаривания, 17β-эстрадиол и прогестерон усиливали представление антигенов и увеличивали численность клеток Лангерганса во влагалищном эпителии. Таким образом, в присутствии 17β-эстрадиола и прогестерона во влагалище наблюдалось усиление защитного действия от патогенов, что предупреждало инфицирование.
Исследования других авторов (Grossman C.J. et al, 1994; Molland J.G. et al., 1990) показали, что половые стероиды в некоторой степени определяют передачу вируса иммунодефицита человека (ВИЧ-1). Они могут способствовать формированию вирусной экспрессии (Grossman C.J. et al., 1994; Molland J.G. et al., 1990).
Выявленные результаты можно трактовать как показатель неоднозначного воздействия прогестерона на иммунитет слизистых на фоне различного содержания эстрогенов.
Так, обобщая полученные в эксперименте результаты, можно предположить, что применение прогестерона на фоне достаточного содержания эстрогенов не повышает чувствительность к инфекциям, а на фоне низкого, наоборот, — повышает риск инфицирования. Это предположительно подтверждается существующими эпидемиологическими данными об увеличении вероятности ВИЧ-1 инфицирования среди женщин, которые принимали высокие дозы медроксипрогестерона ацетата (Huber J., 2001).
На сегодняшний день рассматривается несколько вероятных патогенетических механизмов, которые могли бы объяснить связь между половыми гормонами и риском инфицирования заболеваниями, передающимися половым путем, в том числе ВИЧ-1 (Huber J., 2001).
Это и истончение влагалищного эпителия под влиянием прогестерона, и развитие прогестеронопосредованной эктопии цервикального эпителия. Третьим возможным механизмом может быть стимулирующее влияние прогестерона на функцию антигенного представления, а также на численность клеток Лангерганса, выявленных в эксперименте у грызунов. Резидентные клетки Лангерганса в нижних половых путях женщины являются клетками-мишенями для ВИЧ-1 и представляют особый интерес, поскольку они считаются первыми клетками, инфицируемыми при влагалищной передаче ВИЧ-1 (Huber J., 2001).
Отмечено также стимулирующее действие прогестерона на дендритные клетки, которое отличается двумя разными аспектами. Во время беременности происходит снижение цитотоксичности, опосредованной через Тh2-лимфоциты, благодаря чему возможно выживание плода. Компенсаторно происходит рост численности дендритных клеток, которые поддерживают местную защиту слизистых женщины против микроорганизмов. С другой стороны, прогестеронопосредованное усиленное представление дендритными клетками антигенов Т-лимфоцитам делает женский организм более восприимчивым к ВИЧ- инфицированию (Huber J., 2001).
Таким образом, можно сделать вывод, что репродуктивный тракт женщины является своеобразным мощным иммунокомпетентным органом, судя по выявлению в эндоцервиксе, эктоцервиксе, влагалище макрофагов, CD31, CD4+, CD8+, дендритных клеток, естественных киллеров. При этом уровень упомянутых клеток изменяется как в течение менструального цикла, так и при беременности и, соответственно, в пре- и постменопаузе (Aydin Arici et al., 1999; Milson Г Nilsson L.A. et al., 1991; Nagy E. et al., 1999; White H.D. et al., 1997).
Чрезвычайно сложной и в то же время необыкновенно важной задачей для клинициста является определение первостепенности сексстероиддефицитопосредованных изменений иммунной системы у женщин в менопаузе или инволюционных изменений иммунитета с возрастом.
Так, в ходе эволюции иммунной системы Т-клеточный иммунитет достигает пика в пубертате и со временем постепенно снижается. С началом пубертата половые и надпочечниковые стероиды вызывают инволюцию тимуса, индуцируя апоптоз (программированная клеточная смерть) тимоцитов. С возрастом эндокринная функция тимуса, в частности созревание Т-клеток, уменьшается, что определяется термином "тимусная менопауза" (Бутенко Г.М., 1998; Серова Л.Д., Борисова A.M., 1999; Hadden J.W., 1992; Hadden J.W. et al, 1992).
Как известно (Rutanen E.-M., 1997), система жизнедеятельности тимуса представляет собой сеть паракринных, аутокринных и юкстакринных сигналов (рис. 6), включая интерлейкины и тимусные пептиды, которые синергично функционируют и направлены на созревание Т-лимфоцитов (Hadden J.W., 1992; Hadden J.W. et al., 1992).
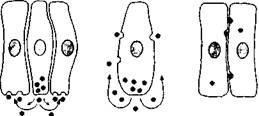
Рисунок 6. Схематическое изображение паракринного, аутокринного и юкстакринного механизмов клеточной регуляции (Rutanen E.-M., 1997). Слева направо: паракринный, аутокринный, юкстакринный.
С возрастом уменьшается продукция незрелых лимфоцитов (Т0) в центральных лимфоидных органах, что приводит к сокращению различия в распознаваемости специфических антигенов ("свое-чужое") иммунной системой. Таким образом, прогрессирующее снижение способности иммунной системы реагировать на чужеродные агенты объясняет увеличение реактивности к аутоиммунным антигенам, что клинически проявляется повышением заболеваемости аутоиммунной патологией (Grossman C.J. et al., 1994; Deborah J. Anderson, 2000).
Возрастные изменения в тимусе объясняются не только внутренними, но и внешними причинами. К внешним факторам относятся изменения содержания стероидных гормонов и уровня циркулирующих в сыворотке крови ИЛ-1 р, ИЛ-2 (Kincade P.W. et al, 2000).
Наряду с инволюцией тимуса периферическая иммунная система также поддается выраженному старению. Установлено (Hadden J.W., 1992; Hadden J.W. et al., 1992), что повреждается Т-клеточная пролиферация и цитокиновый профиль, включая снижение продукции ИЛ-2 и повышение продукции определенных провоспалительных цитокинов (ИЛ-1 р, ИЛ-6, ОНФ) и цитокинов, обеспечивающих гуморальный иммунитет (ИЛ-4, ИЛ-5).
Таким образом, можно сделать вывод, что инволютивные изменения Т-клеточной активности и цитокинового профиля, а значит и В-клеточной дифференциации и синтеза антител, могут способствовать развитию некоторых иммунопатологических состояний, связанных с возрастом, включая остеопороз, атеросклероз и аутоиммунные заболевания (Grossman C.J. et al, 1994; Deborah J. Anderson, 2000; Hadden J.W., 1992; Hadden J.W. et al., 1992).
При этом отчетливо разделить возрастные изменения иммунной системы от сексстероиддефицитопосредованных (менопаузальных) практически не представляется возможным, ибо, как уже упоминалось, изменение уровня половых стероидов является одной из внешних причин старения иммунной системы.
Понимание влияния половых стероидных гормонов на различные звенья иммунной системы чрезвычайно важно для определения тактики лечения различных дисгормональных нарушений у женщин с аутоиммунными заболеваниями и риском их развития, прежде всего для определения в этих случаях показаний для заместительной гормональной терапии, возможности назначения оральных контрацептивов как с лечебной, так и с контрацептивной целью, и при отсутствии противопоказаний — выбор оптимальных препаратов, доз, режимов, путей их введения.
Отмеченная дозозависимость влияния половых стероидных гормонов и способность их сочетанного действия на различные звенья иммунитета требуют от клинициста взвешенного отношения к выбору тактики и методов лечения дисгормональных нарушений с соблюдением принципов высокой селективности и специфичности назначаемых препаратов.
Определенный интерес представляют имеющиеся достаточно немногочисленные данные по применению препаратов ЗГТ, в частности эстрогенов, у пациенток с различными аутоиммунными заболеваниями. Так, на сегодняшний день имеется некоторый положительный опыт применения эстрогенов в дозировках, предусмотренных ЗГТ, у пациенток с ревматоидным артритом, аутоиммунным тиреоидитом и другими Т-клеточноопосредованными аутоиммунными заболеваниями (Da Silva J.A., Hall G.M., 1992; George and Spector T.D., 1996; Michael D., Lockshin M.D., 1995; Skogh Т., 1997).
В то же время неоднозначный и, зачастую, отрицательный эффект отмечается от введения эстрогенов у женщин с В-клеточноопосредованными аутоиммунными заболеваниями, такими как антифосфолипидный синдром, системная красная волчанка и др. (George and Spector T.D., 1996; Skogh Т., 1997).
Относительно высоких доз эстрогенов (препараты оральных контрацептивов), то имеются данные об их свойстве обострять течение системной красной волчанки и при этом уменьшать активность аутоиммунных артритов (Da Silva J.A., Hall G.M., 1992; George and Spector T.D., 1996; Skogh Т., 1997) и аутоиммунных тиреоидитов (Roy S.K., Kole A.R., 1997).
При выборе препарата в каждом конкретном случае в зависимости от наличия или отсутствия экстрагенитальных заболеваний, особенно характеризующихся иммунологическими нарушениями (ревматоидный артрит, аутоиммунный тиреоидит, инсулинозависимый сахарный диабет и др.), чрезвычайно важным является определение преимущественного прогестагена (Donald P., McDonnell, 2000). При этом следует учитывать его способность связываться не только с прогестероновыми рецепторами, но и потенциально взаимодействовать с другими андрогенными, глюкокортикоидными и эстрогенными рецепторами в связи с упомянутым выше влиянием эстрогенов, гестагенов, андрогенов и глюкокортикоидов на иммунную систему. Так, например, при отсутствии полного и всестороннего обследования иммунного и гормонального статуса пациентки целесообразно отдавать предпочтение прогестагенам с селективным, чисто прогестероновым действием (дидрогестерон).
Таким образом, представленные в настоящей публикации данные о влиянии половых стероидных гормонов на иммунную систему позволяют клиницисту рассматривать изменение уровня половых стероидов в ответственные, с точки зрения гормонального гомеостаза, периоды жизни женщины (пубертатный, ранний послеродовый, климактерический) как одно из возможных звеньев порочного круга, лежащего в основе развития аутоиммунной патологии.
С другой стороны, эти данные предопределяют целесообразность исследования иммунной системы у женщин с различными дисгормональными нарушениями, такими как климактерический синдром, предменструальный синдром, нарушение менструального цикла, эндометриоз и др.
