(...)
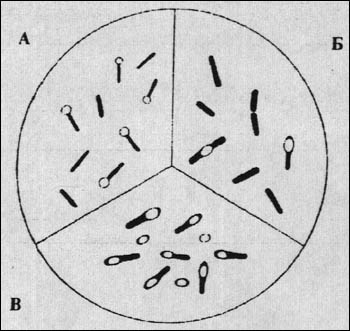
Рис. 1. Клостридии. А -- C. tetani ("барабанные палочки). Б -- C. perfringens (C. welchii). B -- C. botulinum ("теннисные ракетки").
Клостридии вызывают три смертельно опасных заболевания -- газовую гангрену (C. perfringens и другие "гистотоксические" клостридии), столбняк (C. tetani) и ботулизм (C. botulinum). Кроме того, они причастны к патологии пищеварительного тракта, включая относительно доброкачественные энтероколиты и деструктивные процессы, требующие активного врачевания (C. perfringens, C. difficile). Патогенность связана со способностью продуцировать мощные токсины, которые образуются в инфицированном организме или во внешней среде (C. botulinum). Инвазивность почти всегда ограничена, и даже при массивных поражениях (газовая гангрена) носит вторичный характер, следуя за анаэробным повреждением тканей. Не случайно о клостридиях говорят как о "некропаразитах", подчеркивая их неспособность к размножению в живых, хорошо снабжаемых кровью тканях.
CLOSTRIDIUM PERFRINGENS
Подобно другим клостридиям, C. perfringens (син. C. welchii) широко распространены во внешней среде, особенно в окультуренных (унавоженных) почвах. Они сохраняются здесь не только в виде спор, но и активно вегетируют, особенно при повышенной (45 ° C) температуре. Вместе с тем представители этого вида, пожалуй, больше, чем другие клостридии, экологически связаны с кишечником человека и животных. У человека они определяются в количестве 103-105 бактерий на 1 г фекалий. Для сравнения, содержание факультативно-анаэробных бактерий (прежде всего кишечной палочки и энтерококков) составляет 106-107/г, а бактероидов и бифидобактерий, доминирующих в кишечном микробиоценозе, -- 109-1010/г.
Видовой эпитет (perfringens) означает "прорывающий, разламывающий". Он отражает мощную ферментативную активность данного вида клостридий, которые благодаря энергичному газообразованию разрывают питательные среды (рис. 2) и столь же активно ведут себя в инфицированных тканях (рис. 3).

Рис. 2. Глубокие культуры клостридий на сахарном агаре. Бактерии были смешаны с расплавленным агаром, который затем был охлажден до гелеобразного состояния и инкубирован 48 ч при 37° C. Слева направо -- С. perfringens, C. sporogenes, C. tetani. Разрывы агара в культуре C. perfringens связаны с сильным газообразованием.

Рис. 3. Газообразование в подкожной ткани при клостридиальной инфекции.
По спектру продуцируемых токсинов различают пять типов C. perfringens -- А, B, C, D, E. Заболевания человека чаще связаны с типом А (газовая гангрена, пищевое отравление) и изредка -- С (некротизирующий энтероколит). В целом понятие "токсин" у C. perfringens довольно расплывчато, объединяя не менее 14 факторов с летальной и гистолитической активностью. Главными являются альфа (α)-, бета (β)-, эпсилон (ε)- и йота (ι)- токсины. Именно их комбинация определяет тип C. perfringens. Тип А продуцирует единственный из факторов "большой четверки" -- альфа-токсин. Это мощный цитотоксин, обладающий свойствами фосфолипазы С (рис. 4).
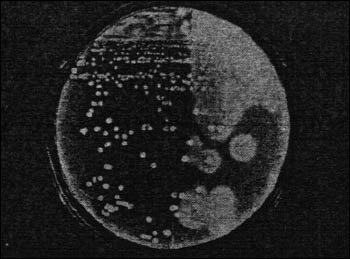
Рис. 4. Лецитиназная (альфа-токсическая) активность в культуре C. perfringens. Агар с пептическим переваром крови и 5% куриного желтка. На правой половине чашки колонии окружены мутным ореолом преципитированных липидов, отщепленных от лецитина куриного желтка клостридиальной лецитиназой (альфа-токсином). Слева опалесценция вокруг колоний отсутствует, так как эта половина чашки была предварительно обработана альфа-антитоксином. Анаэробная культура, 18 ч, 37° C.
Он расщепляет фосфолипиды (лецитин) клеточных мембран, лизируя клетки. При газовой гангрене альфа-токсин служит не только главным эффектором внутритканевой инвазии, но и причиной внутрисосудистого гемолиза -- символа смертельной клостридиальной токсинемии. Из других (минорных) токсинов C. perfringens типа А образует тета (θ) - токсин, или перфринголизин (чувствительный к кислороду гемолизин, похожий на О-стрептолизин стрептококка), каппа (κ) - токсин (коллагеназа), ми (μ) - токсин (гиалуронидаза) и ни (ν) - токсин (ДНК-аза). Они лишены самостоятельного значения, но усиливают действие альфа-токсина.
Штаммы типа А, вызывающие пищевое отравление, продуцируют энтеротоксин. Это термолабильный белок с молекулярной массой 35 кД, который высвобождается в кишечнике при споруляции (образовании спор). Подобно энтеротоксинам холерного вибриона и энтеробактерий, он усиливает секрецию энтероцитами Na+, Cl- и воды, но достигает этого иным путем: он не повышает внутриклеточного уровня цАМФ, а повреждает плазматическую мембрану энтероцитов (единственный такого рода пример среди диареегенных бактерий). Особняком стоит энтеропатогенность C. perfringens типа С. Она связана с бета-токсином и проявляется в виде некротизирующего энтерита.
Газовая гангрена
Гангреной (греч. "разъедающая язва") называется область омертвения (некроза) тканей, которая подвергается гнилостному распаду под влиянием бактерий. Внедрению последних способствует то, что некротизированная ткань не снабжается кровью, лишаясь притока антибактериальных факторов и способности к воспалительной реакции. В сочетании с анаэробиозом это создает идеальную среду для размножения и реализации болезнетворного потенциала анаэробных сапрофитов. Не обладая достаточной агрессивностью для инвазии живой ткани, они играют главную роль в гангренозных поражениях.
Газовая гангрена -- эталон тяжелейших последствий, связанных с клостридиальным заражением некротизированных тканей. Процесс эволюционирует по типу мионекроза -- скоротечного поражения мышц с ничтожными признаками воспаления и обильной продукцией газа (см. рис. 3). К этому предрасполагает размозжением мышечной ткани, которое вызывает местную аноксию и открывает путь для бактериальных спор и вегетативных клеток. Они попадают сюда из внешней среды или из собственной микрофлоры, обычно с инородными телами (почва, обрывки одежды, осколки снарядов и пр.). Чаще всего это наблюдается при боевых ранениях ("болезнь войн"), а в мирное время -- при травмах, полученных в автомобильных и иных катастрофах, после оперативных вмешательств (особенно лапаротомии) и даже обычных инъекций, при кишечной непроходимости и пролежнях. В целом, это оправдывает определение газовой гангрены как "раневой инфекции".
Вегетации клостридий способствует коинфицирование аэробными и факультативно анаэробными бактериями: редуцируя кислород, они усиливают анаэробиоз. Преобладание C. perfringens объясняется несколькими причинами:
1) они чаще других клостридий представлены в почве и микрофлоре человека,
2) обладают одним из самых мощных некротизирующих токсинов -- альфа-токсином,
3) относительно аэротолерантны, а потому менее требовательны к ишемизации тканей,
4) обладают капсулой, усиливающей инвазивность (рис. 5).
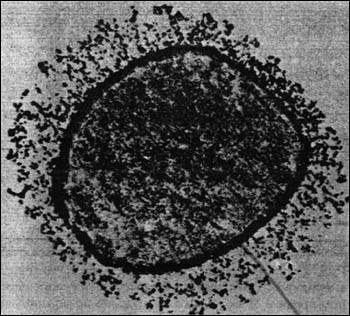
Рис. 5. Электронограмма 6-часовой культуры C. perfringens. Вокруг клетки видна массивная капсула.
После стабилизации инфекта в зоне первичного (травматического или ишемического) некроза клостридии размножаются с выделением альфа-токсина и ферментов, которые расширяют зону некроза, убивая здоровые клетки соседней мышечной ткани (альфа-токсин) и разрушая соединительнотканный матрикс (коллагеназа и др.). Ферментация миоцитарного гликогена ведет к накоплению молочной кислоты и газа, в основном двуокиси углерода и водорода (см. рис. 3). Газообразование определяет характерный симптом клостридиального мионекроза -- крепитацию (от лат. crepitare -- "скрипеть", "хрустеть"), а кислая среда активирует протеолитические ферменты мышечной ткани и аутолитическое высвобождение аминокислот -- великолепного питания для клостридий. Некротические изменения сосудов вызывают отек (отсюда одно из старых названий болезни -- "злокачественный отек"), что вкупе с накоплением газа, повышает внутритканевое давление, углубляя ишемию и тканевой анаэробиоз. Зоны поражения бедны нейтрофилами, которые либо не доходят сюда из-за прекращения кровотока, либо разрушаются клостридиальными токсинами (рис. 6).
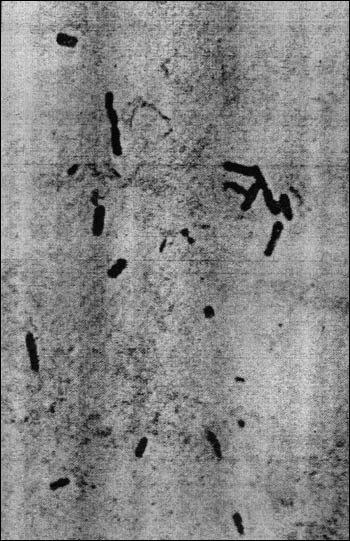
Рис. 6. C. perfringens в экссудате при газовой гангрене. Характерно отсутствие нейтрофилов.
На фоне быстро прогрессирующего мионекроза бактерии захватывают новые участки тканей, распространяясь вслед за деструктивными токсинами и ферментами. Для этого им не требуется активной подвижности: в отличие от остальных клостридий C. perfringens лишены жгутиков. Кожа чернеет, лопаясь под давлением жидкости и газа (рис. 7).

Рис. 7. Газовая гангрена голени (C. perfringens). Осложнение травмы после мотоциклетной аварии.
Всасываясь в кровь, бактериальные токсины (прежде всего альфа-токсин) и продукты тканевого распада вызывают гемолиз, гемоглобинурию и почечную недостаточность. Бактериемия не имеет патогенетического значения и наблюдается лишь в терминальной фазе. Смерть наступает от гипотонии периферических сосудов (шок).
Кроме C. perfringens (выделяется от 60% больных), причиной заболевания могут быть и другие клостридии -- C. oedematiens (C. novyi), C. septicum (20-40%); реже C. histolyticum. В целом, бактериология газовой гангрены варьирует. Часто это смешанная инфекция, так как контаминирующий материал содержит множество бактерий, включая аэробные (синегнойная палочка) и факультативно анаэробные (стрептококки, стафилококки, колиформные бактерии) виды. Они не вызывают некроза мышечной ткани, но помогают анаэробам, редуцируя кислород.
Клостридии вовлекаются и в менее тяжелые раневые процессы типа флегмоны, или (по принятой в зарубежной литературе терминологии) целлюлита. В этом случае поражается подкожная клетчатка, мышцы не затрагиваются. Если бактерии не находят условий для размножения, контаминация не имеет клинических последствий.
Патогенетическое лидерство клостридиальных токсинов при газовой гангрене стимулировало множество исследований по специфической профилактике и лечению раневой инфекции. Были созданы анатоксины и антитоксические сыворотки, широко применявшиеся в годы войны. Однако их эффект скорее иллюзорен, и сегодня они не применяются. Это сопряжено с особенностями патогенеза газовой гангрены: бактерии размножаются и выделяют токсины в тканях, лишенных кровоснабжения (антитела сюда не доходят), а общая интоксикация носит сложный характер, включая действие продуктов тканевого распада. При помощи антитоксинов удается предупредить развитие клостридиальной инфекции у животных, но они не обрывают реального процесса.
Клостридии чувствительны к различным антибиотикам (в частности, к пенициллину), но, не достигая мишени (отсутствие кровотока!), они помогают мало. Наиболее надежна хирургическая обработка ран, нацеленная на ликвидацию анаэробиоза (удаление "мертвых" тканей и дренирование ран).
Пищевые интоксикации и инфекции
В 1945 году был описан острый диарейный синдром после приема пищи, обсемененной C. perfringens. Вслед за стафилококковой интоксикацией и сальмонеллезной инфекцией он считается самым распространенным пищевым отравлением микробной природы. Большинство случаев связано с энтеротоксигенными штаммами типа А, которые отличаются слабой продукцией альфа-токсина, но образуют термолабильный токсин, повреждающий энтероциты (см. выше). Для заболевания характерны схваткообразные боли в животе, зловонный пенящийся понос, изредка рвота и температура. Симптомы возникают через 7-24 ч после приема пищи, выражены обычно умеренно и проходят без лечения через 2-3 дня. Для развития заболевания требуется примерно 108 клеток C. perfringens, которые, подвергаясь споруляции в тонком кишечнике, высвобождают энтеротоксин, накопившийся в бактериях при их вегетации в продуктах питания; в пищеварительном канале возбудитель не размножается. Особенно опасна подогретая пища, оставленная на несколько часов при комнатной температуре, так как, выдерживая кипячение в течение часа, споры быстро прорастают при 40-50° С (рис. 8).
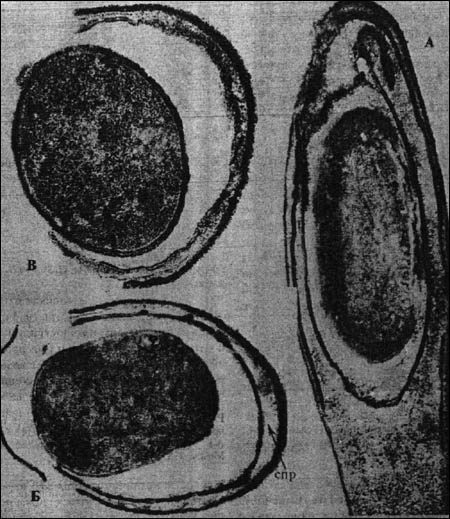
Рис. 8. C. perfringens. Этапы прорастания спор (A -> Б -> В). Электронограмма.
Вероятность патогенетически значимой контаминации пищевых (как правило мясных) продуктов повышается благодаря широкому распространению клостридиальных спор.
Тяжелой (к счастью, редкой) формой клостридиальной патологии является некротизирующий энтерит, вызываемый обычно C. perfringens типа С. Характерен кровавый понос, причиной которого является повреждение слизистой оболочки бета-токсином, образующимся при размножении клостридий в тонком кишечнике. Спорадические случаи описаны во многих странах. Особенно показательны вспышки среди аборигенов Новой Гвинеи во время ритуальных пиршеств с обильным поеданием плохо обработанной свинины. Смертность достигает 30-40%.
CLOSTRIDIUM DIFFICILE
C. difficile (название возникло из-за трудностей культивирования) открыт в 1935 году, то есть значительно позже других клостридий. Вслед за почти полным забвением он был признан главным (возможно, единственным) возбудителем псевдомембранозного колита, ассоциированного с применением антибиотиков, едва ли не главной причины внутрибольничной диареи. Классическим симптомом явлыется понос с примесью крови, которому сопутствуют схваткообразные боли в животе, лейкоцитоз и лихорадка. Очаги поражения, выявляемые в толстом кишечнике, содержат отложения фибрина, остатки некротизированной слизистой оболочки и лейкоцитов (псевдомембрана). Часто процесс протекает в стертых формах, но возможно и фульминантное развитие событий, опасное для жизни.
Подобно всем клостридиям, C. difficile убиквитарен, персистируя в почве, воде и кишечном содержимом многих животных. Вместе с тем они редко (всего в 3% случаев) выделяются из фекалий здоровых взрослых людей. Носительство возрастает у госпитальных больных (13-30%), отражая обмен микрофлорой при плотных контактах. Парадоксом является широкая контаминация здоровых детей -- 14-50%; у новорожденных она достигает даже 90%. Полагают, что токсины C. difficile не рецептируются энтероцитами новорожденных и не вызывают их поражения.
События, ведущие к диарейному синдрому, начинаются с антибиотикозависимого подавления нормакльной микрофлоры, прежде всего анаэробных неспоровых бактерий (бактероидов, бифидобактерий) -- основы колонизационной резистентности толстого кишечника. Наиболее опасны антибиотики типа клиндамицина, которые, обладая высокой активностью против анаэробных бактерий, длительно (до 5 дней) сохраняются в кишечнике после однократного приема. C. difficile выживают благодаря образованию спор. Прорастая после отмены антибиотиков, они дают начало обильному потомству вегетативных клеток, продуцирующих токсины.
C. difficile образует два главных токсина -- А и В. Они секретируются большинством штаммов, обладая неодинаковым спектром биологической активности. Если токсин А избирательно атакует энтероциты, то агрессивность токсина В более универсальна благодаря деполимеризирующему действию на микрофиламенты и повреждение цитоскелета. Антитоксический иммунитет, который удается воспроизвести на животных, клинически не надежен, так как токсины быстро связываются чувствительными клетками, ускользая от нейтрализующих антител. Выявление токсинов в фекалиях рекомендовано для подтверждения клинического диагноза. Это много проще, чем выделение и идентификация культуры C. difficile.
Лечение нацелено на уничтожение вегетирующих клеток C. difficile. Эффективен, в частности, ванкомицин, который благодаря плохой всасываемости при пероральном приеме накапливается в толстом кишечнике. Проблемой остаются рецидивы, поскольку антибиотики не гарантируют полного освобождения от спор и даже способствуют их образованию. В связи с этим логичным выглядит восстановление нормального микробиоценоза при помощи эубиотиков, то есть живых "нормальных" бактерий толстого кишечника. Положительный опыт такого рода экспериментально обоснован, но клиническая значимость современных препаратов (на основе бифидобактерий, лактобацилл, кишечной палочки) сомнительна. Определенные надежды связывают с дрожжами Saccharomyces boulardii (и уже пытаются практически реализовывать), которые неизвестным образом тормозят размножение C. difficile и образование их токсинов в кишечнике.
CLOSTRIDIUM TETANI
Первые описания столбняка (tetanus) встречаются у Гиппократа и других врачей древности. Инфекционная природа заболевания экспериментально обоснована Карлэ и Раттом в 1884 году. Остроумные опыты (1884-1886 гг.) провел Николайер. Он показал, что инокуляция взвеси почвы вызывает столбняк у животных. Обнаружив в зоне инъекции длинные, тонкие палочки, отсутствовашие в других тканях, Николайер предположил, что возбудитель размножается местно, продуцируя стрихниноподобный яд -- непосредственную причину болезни. Розенбах (1886-1887 гг.) подтвердил наблюдения Николайера, выявив у столбнячных больных спорообразующие палочки. Круг сомкнулся, когда Китазато (1889 год) воспроизвел столбняк при введении животным чистой культуры возбудителя. Перед анаэробным культивированием раневого содержимого от больного столбняком он догадался уничтожить неспоровые бактерии, подвергнув исследуемый субстрат термической обработке.
Характерным морфологическим признаком столбнячных бацилл являются круглые терминальные споры, благодаря которым они выглядят как булавки или барабанные палочки (рис. 9).
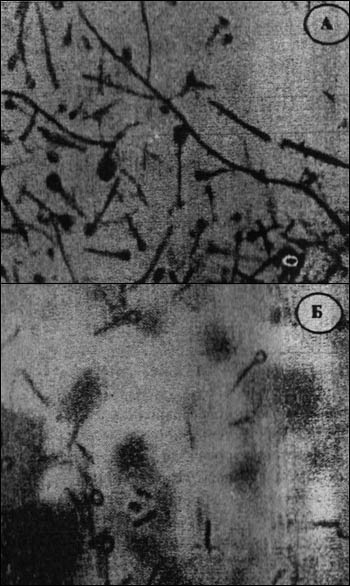
Рис. 9. C. tetani. А -- чистая культура, Б -- экссудат из раны человека, больного столбняком. Длинные тонкие палочки с терминальными спорами в виде "барабанных палочек".
В культурах споры образуются через несколько суток и, по разным данным, переносят кипячение от 20 минут до 3 часов. Подвижны, и по антигенным особенностям жгутиков подразделяются по меньшей мере на десять серотипов. Впрочем, это не имеет практического значения, так как все разновидности C. tetani вырабатывают идентичный нейротоксин, что обеспечивает единство патогенеза и унификацию иммунопрофилактики.
Клостридии столбняка широко распространены в природе, прежде всего в почве, особенно на возделываемых (окультуренных) участках. Нередко они обнаруживаются и в кишечнике человека и животных, хотя "стиль их жизни" в этом случае остается загадкой. Возможно, столбнячные бациллы не размножаются там, проходя транзитом в виде спор. Не исключена и вегетация, о чем говорят следы противостолбнячного антитоксина в сыворотке здоровых животных. Но если это и так, столбняк никогда не возникает при всасывании токсина из кишечника, тем более что вызвать заболевание путем перорального введения токсина не удается.
Столбняк развивается как раневая инфекция, но далеко не каждое ранение создает условия для прорастания спор и размножения бактерий. C. tetani принадлежит к числу наиболее строгих анаэробов, и во многих случаях это спасает от фатальных последствий. Глубокая гипоксия, необходимая для токсинообразования, как правило, возникает в зоне некроза, и все, что было создано о возбудителях газовой гангрены, справедливо для столбнячных клостридий. Однако, отмечая опасность тяжелых травм, следует помнить, что даже малые повреждения могут стать причиной столбняка. Коварны колотые раны (от гвоздей, заноз, колючек и пр.), в глубине которых возникает анаэробиоз. Неслучайно, что у 20% больных отсутствуют указания на травму. Это не означает, что ее не было: просто она не запомнилась из-за незначительности. Есть подозрения, что столбнячные споры могут персистировать в тканях. По крайней мере, известны случаи столбняка, спровоцированные локальной ишемией спустя 10 и более лет после предполагаемого заражения. У новорожденных инфекция проникает через пупочный канатик, так что tetanus neonatorum (рис. 10) остается реальностью в странах с низкой санитарной культурой и плохо налаженной иммунопрофилактикой.
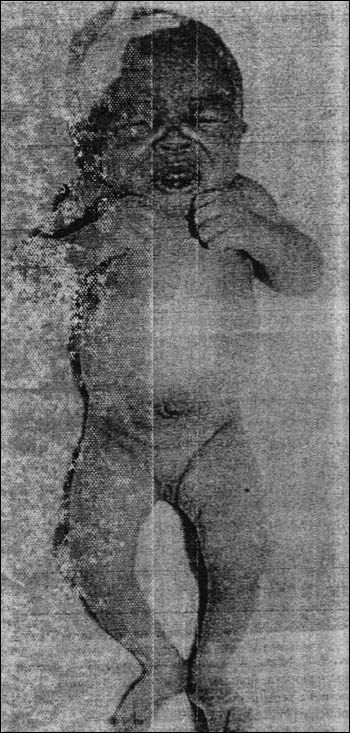
Рис. 10. Столбняк у новорожденного (tetanus neonatorum). Симптом "сардонической улыбки" (risus sardonicus).
Беременные женщины должны вакцинироваться столбнячным анатоксином, чтобы обеспечить пассивный иммунитет новорожденных.
В отличие от гистотоксических клостридий, C. tetani лишен инвазивности (возбудитель не покидает места первичного заражения, и заболевание всегда протекает как интоксикация на фоне малосимптомной очаговой инфекции. Столбнячный нейротоксин называется тетаноспазмином, что подчеркивает ведущий (по сути единственный) пактогенетический механизм столбняка -- спастически параличи поперечно-полосатых мышц. Столбнячный токсин принадлежит к классике микробной токсинологии, уступая по биологической активности только ботулиническому яду. Вслед за человеком к нему наиболее восприимчивы лошади, белые мыши и морские свинки; птицы и хладнокровные животные резистентны к столбняку. Смертельная доза для мыши составляет всего 3 x 10-11 г, то есть 1 мг достаточно, чтобы убить 50-70 млн мышей (!).
Способность к токсинообразованию закодирована в плазмиде и неодинаково выражена у разных штаммов -- от нетоксигенных до высокотоксигенных вариантов. Токсин накапливается внутри клеток и высвобождается при аутолизе и образовании спор. Это белок с молекулярной массой 150 000, который состоит из двух цепей (тяжелой и легкой) и активируется собственными (C. tetani) и тканевыми протеазами. Этапность интоксикации сводится к следующему. Тяжелая цепь активированного токсина рецептируется нервными окончаниями в нервно-мышечных синапсах благодаря связыванию с ганглиозидами пресинаптической мембраны мотонейронов. Рецепция отличается высокой избирательностью, объясняя поразительную токсичность клостридиальных нейротоксинов, прицельно атакующих нейроны. После эндоцитоза нервными окончаниями комплекс рецептор-токсин вливается в поток ретроградного внутриаксонального транспорта, достигая передних рогов спинного мозга. Здесь, после высвобождения в синаптическое пространство между телом мотонейрона и тормозящими интернейронами, токсин вновь подвергается эндоцитозу -- на этот раз тормозящими нейронами. В дело вступает легкая субъединица. Обладая активностью цинкзависимой эндопептидазы, она инактивирует факторы (синаптобревины), необходимые для секреции медиаторов (глицина, гамма-аминобутировой кислоты), блокирующих возбуждение мотонейронов. Это повышает их раздражимость и ведет к стойким мышечным контрактурам -- спастическим параличам. При достаточной дозировке токсина в процесс вовлекаются соседние мотонейроны, что вызывает генерализацию мышечных контрактур.
Развитие симптомов при введении токсина мыши под кожу задней конечности выглядит следующим образом. Сначала обнаруживаются признаки местного столбняка: нога вытягивается, как палка, и при движениях беспомощно тащится, хвост становится ригидным и изогнутым. Спазм распространяется на мышцы той же половины туловища, приводя к искривлению тела в сторону пораженной кончности (рис. 11).
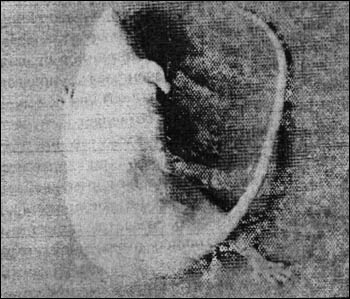
Рис. 11. Столбняк у мыши через 24 ч после подкожного введения у основания хвоста столбнячного анатоксина (0,2 мл 7-дневной бульонной культуры C. tetani).
Контрактуры захватывают противоположную сторону тела, и животное гибнет от "общего" столбняка. Такая картина типична для мелких животных и называется "восходящим столбняком" (tetanus ascendens). У человека последовательность мышечных поражений не связана с зоной первичного токсинообразования, а имеет характер нисходящего процесса -- tetanus descendens. Он начинается со сведения жевательных мышц (тризм -- греч. стискивание, сжатие) и затылочной мускулатуры. Затем спазмируются мышцы лица, обретающего подобие вынужденной улыбки (risus sardonicus; см. рис. 10), и далее -- мускулатура туловища и конечностей. Поскольку мышцы спины сильнее мышц живота, тело напоминает дугу -- опистотонус (от греч. opisthios -- задний, tonos -- напряжение; рис. 12).

Рис. 12. Опистотонус и "сардоническая улыбка" при столбняке. Классическая зарисовка с британского слодата, заболевшего столбняком в 1809 году в эпоху наполеоновских войн.
Из-за повышенной возбудимости мотонейронов к мышечным спазмам присоединяются приступы судорог даже от слабых раздражителей (шум, движение воздуха). Чувствительная сфера не затрагивается, больной остается в сознании. Смерть наступает от асфиксии из-за паралича мышц грудной клетки и диафрагмы.
Условия для нисходящего столбняка возникают после всасывания токсина в кровь (токсинемия). С кровью он разносится по тканям, где фиксируется окончаниями двигательных нервов. Восходящий столбняк протекает без токсинемии, в результате связывания токсина нервными окончаниями в зоне образования или введения. Внутрисосудистая инъекция токсина всегда вызывает нисходящий столбняк. При этом этапность спастического поражения мышц (в частности, опережающее вовлечение мышц головы и шеи) отражает их удаленность от центральной нервной системы, то есть расстояние, которое должен пройти токсин до своих мишеней -- мотонейронов, иннервирующих соответствующую группу мышц (средняя скорость внутриаксонального тока жидкости -- 250 мм в сутки). Этим в известной мере определяется и длительность инкубационного периода: у человека он составляет 7-10 дней (с колебаниями от 2 до 5- дней), а у животных возрастает с увеличением размеров тела (например, 12 ч у мыши и 5 дней у лошади).
Даже при лечении антитоксической сывороткой смертность составляет 15-80% и в целом обратно пропорциональна продолжительности инкубации. Критическими являются первые дни заболевания, отражая старинное правило Гиппократа: "Люди, "схваченные" столбняком, умирают в течение четырех дней или не умирают вообще". Столбняк не оставляет иммунитета, так как ничтожное количество токсина, продуцируемое возбудителем, быстро связывается нервной тканью и ускользает от иммунной реакции. Вместе с тем токсин, обезвреженный формалином (анатоксин), создает великолепный иммунитет, и при хорошо отлаженной иммунопрофилактике столбняк -- большая редкость. Экстренную профилактику проводят при помощи антитоксических сывороток или гомологичного (человеческого) противостолбнячного иммуноглобулина. При этом надлежит помнить, что время решает все, так как после эндоцитоза токсин недоступен для антител. Неоценимую роль играет хирургическая обработка ран. Показаны и антибиотики, которые полезны не только для подавления столбнячной палочки, но и сопутствующей (кислородредуцирующей) флоры. Подобно другим клостридиям, C. tetani чувствителен к пенициллину, цефалоспорину, тетрациклину, метронидазолу и др.
Для диагноза достаточно характерной клинической симптоматики. Бактериологического подтверждения обычно не требуется, тем более что в организме споры образуются не всегда, и типичные бациллы ("барабанные палочки") выявляются редко. Возбудитель может быть выделен из раны, но работа с анаэробами требует специальных условий, которых лишены стандартные микробиологические лаборатории. Возможна и биологическая проба на мышах с кровью больного. Но ее результаты непостоянны и воспроизводимы лишь при гипертоксинемии.
CLOSTRIDIUM BOTULINUM
Ботулинические клостридии вызывают тяжелое пищевое отравление, изначально описанное после употребления зараженной колбасы (лат. botulus -- колбаса). Возбудитель был выделен в 1896 году в Бельгии ван Эрменгемом из ветчины, послужившей причиной группового заболевания с несколькими смертельными исходами. Фильтраты культур, выраженных в строго анаэробных условиях, содержали токсин и (так же, как экстракт ветчины) вызывали характерные симптомы при скармливании животным (кошкам).
Для C. botulinum характерны споры овальной формы, которые располагаются субтерминально и придают палочкам вид ракетки (см. рис. 1). Они принадлежат к числу наиболее устойчивых спор, выдерживая кипячение в течение нескольких (по некоторым данным до 20) часов. Автоклавирование при 120° С убивает их через 20 минут. Токсин ботулинических клостридий тоже относительно стабилен: при 80° С он разрушается через 30-40 минут, а при 100° С -- через 10 минут.
С практической точки зрения ботулиничеквие клостридии удобно рассматривать как единый вид, хотя на самом деле это довольно разнородная группа бактерий, продуцирующих фармакологически сходный, но антигенно различный токсин. Известно 8 серологических вариантов ботулинического токсина и, соответственно, 8 серотипов C. botulinum -- A, B, C1, C2, D, E, F, G. Токсины C, D и Е закодированы в умеренных фагах, остальные -- в хромосоме.
Ботулинический токсин считается самым сильным ядом биологического происхождения, но по неясным причинам чувствительность разных животных к его вариантам неодинакова. Человек поражается только токсинами А, В, Е и F, безвредными для млекопитающих и птиц. Непонятно и то, почему некоторые животные (например, крысы, собаки, куры) отлично переносят ботулинический яд, а другие (мыши, морские свинки, кошки, лошади, утки) высокочувствительны к нему. Человек, по-видимому, наиболее восприимчив к ботулизму. Особенно опасен токсин А, смертельная доза которого для человека составляет всего 10-8 г (6 кг достаточно, чтобы отравить все человечество!).
Из всех патогенных клостридий ботулинические клостридии больше всего отвечают критериям сапрофитизма. Они широко распространены не только в "окультуренной" почве, но и в девственных районах, не связанных с жизнедеятельностью человека. Их присутствие доказано в иле рек и озер, откуда они попадают в кишечник рыб и водоплавающих птиц. Реже, чем другие клостридии, C. botulinum обнаруживается в пищеварительном канале домашних животных и лишь изредка у человека. Многие штаммы лучше размножаются при 25° C, что также подчеркивает независимость от теплокровных животных.
Благодаря широкому распространению споры C. botulinum могут инфицировать любые продукты растительного и животного происхождения. Вместе с тем ботулизм -- редкое заболевание, так как возбудитель обычно не размножается в организме или по крайней мере не продуцирует в нем токсина. Поэтому свежая (сырая или вскоре после кулинарной обработки) пища не представляет опасности. Угроза возникает лишь при прорастании спор и размножении C. botulinum. В подходящих условиях для накопления патогенетически значимой концентрации токсина в культуре клостридий типа А достаточно суток. Хранение в холодильнике не снимает опасности, так как токсин (особенно типа Е) медленно (несколько недель) образуется даже при 3-5° С. Коварность ботулинических клостридий состоит и в том, что продукция токсина почти не влияет на вкусовые качества пищи. Можно лишь отметить запах прогорклого масла: он характерен и для чистых культур C. botulinum.
Вегетации бактерий и образованию токсина противодействуют многие факторы, что резко снижает вероятность ботулизма даже при обильном обсеменении продуктов. Так, прорастание спор подавляется в кислой (pH 4,5) среде (соответствует 2% раствору уксуса в маринадах) и при 10% концентрации хлористого натрия (полезно помнить при солении рыбы). Абсолютным условием для токсинообразования служит отсутствие кислорода (закатанные банки с консервами, герметизация в полиэтиленовых пакетах, размножение внутри мясного фарша и пр.). С неравномерностью накопления токсина в продукте и более медленным повышением температуры внутри его массы при термической обработке связаны случаи избирательного поражения ботулизмом после употребления общего продукта.
Токсин высвобождается при аутолизе бактерий (усиливается при образовании спор) в виде комплекса с инертными белками. Они экранизируют токсический компонент от протеолитических ферментов и кислой среды желудка. Но эта защита относительна, и при пероральном введении до цели доходит лишь малая часть токсина. Этим объясняется то, что при скармливании токсина чувствительность к нему у животных в 1000-1500 раз меньше, чем при парентеральном введении. По ряду структурно-функциональных признаков ботулинический токсин похож на столбнячный тетаноспазмин (см. выше). Это полипептидная цепь (молекулярная масса 150 000) с одной или несколькими внутримолекулярными дисульфидными связями. В нативном виде малотоксичен, но активность возрастает под влиянием трипсина, тканевых и собственных (клостридиальных) протеиназ. Они расщепляют молекулу на два субкомпонента (легкий и тяжелый), которые до внедрения в чувствительные клетки (нейроны) скреплены дисульфидной связью и соответствуют А- и В-фрагментам бинарных токсинов. После всасывания из тонкого кишечника тяжелая субъединица токсина избирательно связывается ганглиозидами пресинаптической мембраны мотонейронов, вызывая эндоцитоз всей молекулы нервными окончаниями. В отличие от столбнячного токсина ее путь на этом заканчивается, то есть эффект ограничивается периферической нервной системой. После восстановления дисульфидной связи легкая субъединица высвобождается из эндосом и, действуя как эндопептидаза, разрушает факторы (синаптобревины), необходимые для секреции ацетилхолина. Это обрывает нервные импульсы, идущие от мотонейронов к мышечным волокнам, приводя к необратимой релаксации последних -- вялым параличам (рис. 13).
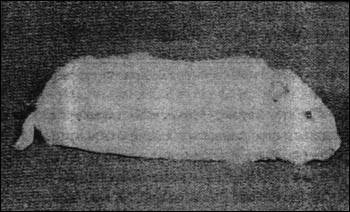
Рис. 13. Ботулизм у морской свинки, получившей перорально 0,25 мл 10-дневной культуры C. botulinum. Через 18 ч у нее развился вялый паралич живота и шеи, появились слюнотечение, непроизвольные мочеиспускание и дефекция (за несколько минут до фотографирования). Дыхание поверхностное, с хрипами. Способность к произвольным движениям утрачена за исключением слабого шевеления задними конечностями и ушами.
Вовлечение краниальных нервов ведет к диплопии (двойное видение), дисфагии (затруднение глотания) и дисфонии (затруднение речи). Зрачки расширены и неподвижны. Из-за ослабления или даже прекращения секреции слюны возникает сухость во рту, падает тонус мышц шеи и туловища. Летальность достигает 20-40% на фоне паралича дыхательных мышц или сердечной недостаточности. Сознание сохраняется вплоть до смерти.
Следуя патогенетической логике, больным вводят антитоксические сыворотки против токсинов (А, В и Е), доминирующих при ботулизме у человека. Но, обладая профилактическим эффектом, они приносят мало пользы в борьбе с уже развившимся заболеванием. Как и при столбняке, токсин, транслоцированный в нейроны, недоступен для антител.
Для подтверждения диагноза проводят определение токсина в сыворотке, фекалиях, желудочном содержимом, рвотных массах и экстрактах из пищевых продуктов (биологическая проба на мышах, иммунохимические тесты).
Раневой ботулизм
Клостридии ботулизма способны размножаться и продуцировать токсин при заражении ран, особенно в условиях смешанной инфекции. Это казуистика, но она экологически сближает C. botulinum с другими болезнетворными клостридиями.
Ботулизм младенцев
В качестве самостоятельной нозологической формы утвержден в 1976 году. Поражаются дети до 6 месяцев, в среднем 2,5 месяцев. Болезнь обычно протекает легко и не диагностируется. Клинические признаки включают запор (первый симптом), вялость, затруднение сосания и глотания, измененный плач, мышечную слабость. В тяжелых случаях возникают симптомы "взрослого" ботулизма, но летальность не превышает 4%. Допускают, что ботулиническая интоксикация является причиной некоторых случаев внезапной смерти новорожденных ("смерть в колыбели").
Принципиально, что в отличие от ботулизма взрослых младенческий ботулизм развивается как инфекционный процесс: токсин образуется при вегетации спор, попавших в толстый кишечник. Это может быть связано с особенностями кишечной микрофлоры у малышей, не оказывающей должного сопротивления C. botulinum. Что касается источников инфекции, то они остаются загадкой, хотя, памятуя о широком распространении клостридиальных спор, имеется масса возможностей для контаминации
