|
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
В последние годы значительно возрос интерес к проблеме внутриутробных и перинатальных инфекций, среди которых особое внимание уделяется герпесвирусным инфекциям и, в частности, цитомегаловирусной инфекции. Герпетическая и цитомегаловирусная инфекции остаются одной из ведущих причин мертворождаемости, самопроизвольных выкидышей, преждевременных родов, заболеваемости новорожденных и младенческой смертности: согласно отечественной статистике, внутриутробные инфекции развиваются у 27,4 – 36,6% детей, рожденных живыми, а в структуре причин смертности новорожденных инфекционная патология занимает 1-3 место, обусловливая от 11 до 45% потерь, мертворождаемость при этой патологии достигает 14,9 – 16,8% [Е. И. Боровкова et al., 2004; А. Туки et al., 2000].
ЦМВИ (синонимы: цитомегалия, инклюзионная болезнь) – широко распространенная антропонозная инфекция из группы герпесвируса с необычайно широким спектром клинико-патогенетических вариантов [В. И. Кулаков et al., 2001]. Так как ЦМВИ относится к оппортунистическим инфекциям, особенное значение она приобретает в рамках того, что в последние годы распространенность иммунодефицитных состояний существенно повысилась в связи с появлением ВИЧ-инфекции, действием факторов, нарушающих экологическое равновесие, различными ятрогенными вмешательствами (лекарственная болезнь, гемотрансфузии, применение цитостатиков, в частности, при трансплантации органов и тканей) [В. И. Кулаков et al., 2001].
Врожденная цитомегаловирусная инфекция, являясь самой частой инфекционной фетопатией, представляет значительную проблему из-за возможности реализации тяжелого генерализованного процесса, врожденных пороков развития и потенциального риска формирования хронической патологии. По тератогенной значимости ЦМВ занимает 2 место после вируса краснухи. Способность вируса к длительной персистенции в ЦНС приводит к развитию у плода специфического энцефалита, в исходе которого нередко формируются неврологические дефекты в виде умственной отсталости, эпилепсии, сенсорно-невральной глухоты. Способность вируса реплицироваться в клетках иммунной системы и индуцировать ее недостаточность является фоном для развития рецидивирующих септических, грибковых и вирусных заболеваний. Повреждение иммунной системы на этапах раннего онтогенетического развития может приводить к необычному формированию иммунных реакций и неадекватности иммунного ответа в позднем онтогенезе. Это проявляется отсроченной патологией, развитием аллергических и аутоиммунных заболеваний [К. В. Орехов et al., 2004; Л. Л. Нисевич et al., 1999; К. И. Григорьев, 2004]. С врожденной ЦМВИ связывают высокую частоту болезни Дауна [К. И. Григорьев, 2004].
Кроме того, инфицированность ЦМВИ проявляется утяжелением течения заболеваний, вызванных другими патогенами. При бронхолегочной патологии ДНК ЦМВ выявлялась в 52,6% случаев, причем особенно часто (в 72,7%) ее детектировали при острых деструктивных пневмониях. У детей с ХОБЛ этот показатель составил 42%. При этом отмечалась также корреляция между частотой выявления ЦМВ и тяжестью заболевания [О. Ю. Манзенюк et al., 2003]
К сожалению, в России частота ЦМВИ официально не регистрируется [В. Л. Тютюнник et al., 2002]. По данным разных исследовательских групп, популяционная инфицированность женщин фертильного возраста герпетической, ЦМВ- или коксакивирусной инфекции в Москве превышает 80-90% [Е. И. Боровкова et al., 2004]. Примерно 1% детей рождаются с признаками ЦМВИ, частота ЦМВИ новорожденных – 0,2 – 2,5% [К. Фризе et al., 2003; В. И. Кулаков et al., 2001]. В Омской области инфицированность ЦМВ среди взрослого населения составляет 76,5% [Т. И. Долгих et al., 2004].
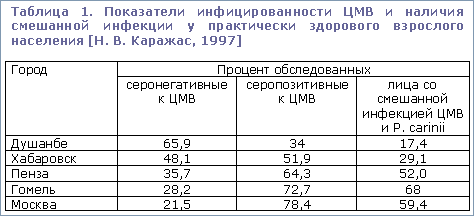
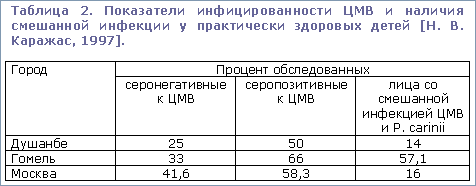
Число серопозитивных пациентов в разных странах мира колеблется в среднем от 44 до 85%, больных – от 0,2 до 3% [В. И. Кулаков et al., 2001]. По другим данным, уровень серопозитивности населения к ЦМВ в разных странах мира колеблется от 40 до 100%, в России составляет 32 – 94,7% [К. В. Орехов et al., 2004].
В США при 4 млн родов в год и приблизительно при 1% врожденно инфицированных младенцев ежегодно примерно 8700 детей страдают ранними и поздними осложнениями цитомегаловирусной инфекции [Н. В. Каражас, 1997; К. Фризе et al., 2003]. В Германии при 810 000 родов в год доля врожденно инфицированных младенцев 0,2 – 0,3%, у 500 детей ежегодно проявляются ранние и поздние ЦМВ-повреждения [К. Фризе et al., 2003]. Кроме того, по данным исследователей США, у 3,5-20% практически здоровых беременных из канала шейки матки был выделен ЦМВ [Н. В. Каражас, 1997].
P. Bos et al. выявили противоцитомегаловирусные IgM-антитела у 19,2% женщин, страдающих бесплодием, T. Guo – у 6,8% беременных. В масштабном исследовании НИИ акушерства и гинекологии республики Казахстан первичная ЦМВИ выявлена у 31,2% женщин с угрозой прерывания беременности, у 18,2% - с самопроизвольным выкидышем, у 39,5% - с преждевременными родами, у 53,4% - с многоводием, у 35,4% - с неразвивающейся беременностью [Д. Б. Асранкулова, 2003].
У многих выживших детей длительно, а иногда в течение всей жизни, сохраняются осложнения: у 28,% - отставание в умственном развитии, у 58% - нейромышечные нарушения, в том числе церебральный паралич, а также соматосенсорная недостаточность, у 20% - потеря слуха, у 24% - нарушения зрения [Н. В. Каражас, 1997].
Все это привело Европейское региональное бюро ВОЗ в 1984 году к решению включить ЦМВИ в группу заболеваний, которые определяют будущее инфекционной патологии [В. И. Кулаков et al., 2001]. Кроме того, ВОЗ включила ЦМВИ в синдром внутриутробной инфекционной патологии, так называемый TORCH-синдром, в который входят T – токсоплазмоз, O – сифилис, листериоз и прочие инфекции, R – краснуха, C – цитомегаловирусная инфекция и хламидиоз, H – герпес и гепатит С [Л. Б. Кистенева, 2003].
ЭТИОЛОГИЯ
Возбудитель ЦМВИ в современной классификации вирусов относится к виду Cytomegalovirus hominis, подцарству Deoxyvira, классу Deoxicubika, порядку Haplovirales, семейству Herpesviridae (герпесвирус человека 5), подсемейству Betahepresviridae и роду Cytomegalovirus [К. В. Орехов et al., 2004]. В настоящее время в международных каталогах зарегистрировано 4 штамма ЦМВ: АД169, Davis, Towne Kerr. Этиологическое значение для человека имеют все 4 штамма. От одного человека можно выделить несколько штаммов этого вируса [В. И. Кулаков et al., 2001; А. П. Обрядина, 2005]. Четко различающихся серотипов нет. Степень родства отдельных вирусных изолятов может быть выявлена с помощью молекулярно-биологического анализа, что пригодно для установления инфекционных цепочек (мать-ребенок, половые партнеры etc.) [К. Фризе et al., 2003].
ЦМВ относительно термолабилен: утрачивает инфекционные свойства при 10-20-минутном нагревании до 56° С. При комнатной температуре (22° С) вирус сохраняется до 2 недель, при 37° С его полная инактивация наступает через 2 недели [В. И. Кулаков et al., 2001]. Вирус в течение 30 минут персистирует на игрушках, в течение 2 ч – на поверхности предметов, на которую попала слюна, и в течение 48 ч – на пеленках [Н. В. Каражас, 1997].
Вирус чувствителен к повторному замораживанию и оттаиванию. Быстрое охлаждение до -50° С инактивирует ЦМВ; постепенное охлаждение он переносит лучше. Вирус плохо сохраняется в замороженном состоянии при -20° С, утрачивая инфекционные свойства через 3 недели. Ультрафиолетовое облучение полностью инактивирует вирус через 7 минут. ЦМВ чувствителен к эфиру и другим растворителям липидов. При pH среды 10,0-11,0 инактивация вируса наступает через 10 дней, при pH 5,6-6,0 – через 18 ч и при pH 3,0-4,0 – в течение 1 ч. Оптимальные для ЦМВ значения pH – 7,2-8,0. Таким образом, считается, что ЦМВ быстро инактивируется во внешней среде и для поддержания в условиях лаборатории требует систематических пассажей в клеточных культурах.
Наиболее интенсивно ЦМВ размножается в культурах фибробластов гомологичных хозяев [В. И. Кулаков et al., 2001]. Кроме того, хорошо культивируется вирус в культурах диплоидных клеток из легких эмбриона человека [К. В. Орехов et al., 2004]. Эпителиальные клетки малочувствительны к ЦМВ. Возможно размножение ЦМВ в клеточных культурах, полученных из щитовидной железы взрослого человека, а также в клеточных культурах почек плода человека. Размножение ЦМВ в культурах чувствительных клеток сопровождается развитием цитопатического эффекта в сроки от 24 часов до 1 месяца после заражения. Наиболее ощутимые дегенеративные изменения в клетках в виде возникновения гигантских (25-40 мкм) "цитомегалических" клеток с типичными внутриядерными включениями возникают между 5 и 20 днем культивирования. Медленное развитие цитопатического эффекта является характерной биологической особенностью ЦМВ [В. И. Кулаков et al., 2001]. Вместе с тем для ЦМВ характерен короткий цикл репродукции [В. Л. Тютюнник et al., 2002].
ИСТОЧНИКИ ИНФЕКЦИИ И ПУТИ ПЕРЕДАЧИ
Источниками инфекции могут быть носители ЦМВ или больные ЦМВИ. Вирус передается через биологические жидкости и выделения:
1. кровь,
2. мочу,
3. слюну,
4. слезную жидкость,
5. отделяемое носоглотки,
6. спинно-мозговую жидкость,
7. грудное молоко,
8. околоплодные воды,
9. цервикальный и вагинальный секреты,
10. сперму,
11. фекалии.
Пути передачи ЦМВ многочисленны, заражение происходит относительно легко.
Возможны следующие механизмы и пути передачи ЦМВ в естественных условиях:
1. Фекально-оральный, для которого характерен бытовой путь передачи через загрязненные руки, различные предметы обихода, используемые для питья, еды, курения, игр etc.
2. Аспирационный, при котором основную роль играет воздушно-капельный путь передачи.
3. Контактный, когда инфекция передается через поврежденные кожные покровы и мацерированные слизистые оболочки.
4. Вертикальный – переход возбудителя от матери к плоду. Этот механизм определяет развитие внутриутробной инфекции.
Передача ЦМВ от матери к плоду возможна в течение всей беременности. Однако последствия инфекции значительно серьезнее при инфицировании в первой половине гестационного периода [В. И. Кулаков et al., 2001]. Особую опасность для плода представляет острая первичная ЦМВИ у беременных женщин: если беременная женщина страдает первичной инфекцией, вероятность инфицирования плода повышается до 40-50% [Е. А. Григорьева et al., 2003; К. Фризе et al., 2003]. Поражается лишь 1% новорожденных, если у матери рецидивирующая инфекция [К. Фризе et al., 2003].
Наиболее вероятными средствами трансмиссии ЦМВ считают половые пути и грудное молоко. Грудное молоко "ответственно" за инфицирование в среднем 63% новорожденных, а поражение половых путей матери – 26 – 57% [В. И. Кулаков et al., 2001], по другим данным, 58 и 12,5 – 26% соответственно [Н. В. Каражас, 1997]. Трансплацентарная передача вируса – главная причина антенатальных повреждений. При этом вирус, нарушая плацентарный барьер, проникает из межворсинчатого пространства в кровоток плода с последующей диссеминацией в его органах. Поражается и плодовая часть плаценты. Возможно развитие синдрома "инфекции околоплодных вод", когда вирусы с током крови достигают околоплодных оболочек, адсорбируются на них и инфицируют амниотическую жидкость. Инфицирование вод может происходить также восходящим путем – через родовой канал, при преждевременном или раннем повреждении плодных оболочек и нисходящим – через синцитий хориона, из брюшной полости через маточные трубы. Плод может инфицироваться околоплодными водами и при их аспирации и заглатывании, через кожные покровы и конъюнктиву. Восходящий путь инфицирования возможен также при прохождении плодом родового канала, что обусловливает заражение в интранатальном периоде.
Существенная роль отводится непосредственному воздействию на эмбрион и плод; интоксикации продуктами нарушенного метаболизма матери (ацидоз, изменения клеточных мембран), а также продуктами распада вируса; гипертермии и гипоксии.
Возможна передача ЦМВ и при половом контакте [В. И. Кулаков et al., 2001; Н. В. Каражас, 1997]. Примерно у 30% здоровых мужчин в сперме содержался ЦМВ [Н. В. Каражас, 1997].
Поскольку ЦМВ проявляет особый тропизм к клеткам слюнных желез, не исключена передача вируса при поцелуях, поэтому ЦМВИ в иностранной литературе называют также "болезнью поцелуев". В связи с этим рассматривают две волны заболеваемости ЦМВИ: в трехлетнем возрасте и в периоде полового созревания [В. И. Кулаков et al., 2001]. Однако, по данным M. Ryan et al., в Англии пик частоты острой ЦМВИ приходится на возрастной период 25-34 года [Д. Б. Асранкулова, 2003]. Кроме того, ЦМВИ остается универсальной профессиональной болезнью проституток, а также частым заболеванием мужчин-гомосексуалистов [В. И. Кулаков et al., 2001]. У 90% из них обнаружены IgM-антитела, что указывает на свежую инфекцию [Н. В. Каражас, 1997]. M. Kiyan et al. выявил противоцитомегаловирусные IgM-антитела у 22,2% лиц, представляющих сексуальные меньшинства [Д. Б. Асранкулова, 2003].
Искусственная передача ЦМВ возможна при парентеральных манипуляциях, трансплантации органов и тканей, гемотрансфузиях. В трансплантологии источниками ЦМВ могут быть донорские органы и ткани, особенно костный мозг и почки. Инфицирование возможно и при трансфузии серопозитивной (инфицированной) крови серонегативным реципиентам, в том числе беременным и недоношенным новорожденным. Особенно велик риск инфицирования детей при заменных переливаниях крови или повторных гемотрансфузиях от эпидемиологически опасных доноров [В. И. Кулаков et al., 2001]. Немецкие ученые, обследовав 3450 доноров, выявили, что у 56% из них имелись специфические антитела к ЦМВ. По данным американских исследователей, у ряда доноров до 2% лейкоцитов содержали преранние белки ЦМВ. Имеются сообщения о том, что после пересадки органов у 90% реципиентов обнаруживаются признаки ЦМВИ, у 10% - клинически выраженная инфекция, у 20% - цитомегаловирусная пневмония. Пневмония развивается в течение 8 недель после трансплантации и в 90% случаев приводит к летальному исходу. Свежие антитела класса IgM могут выявляться в интервале от 6 до 12 недель после трансплантации. При этом помимо передачи вируса от донора к реципиенту, может происходить активизация латентного вируса на фоне терапии иммуносупрессорами в сочетании со стероидными и антибактериальными средствами [Н. В. Каражас, 1997]. Например, при выявлении причин посттрансфузионной лихорадки у больных, оперированных по поводу заболеваний сердца, в крови реципиентов были обнаружены комплементфиксирующие антитела к ЦМВ, при этом в донорских сыворотках и дооперационных сыворотках реципиентов антител к ЦМВ не находили [Л. Б. Кистенева, 2003].
ДРУГИЕ ФАКТОРЫ РИСКА
Сезонность, вспышки, эпидемии нехарактерны для ЦМВИ [В. И. Кулаков et al., 2001]. Однако, хотя эпидемий ЦМВИ до настоящего времени не было зарегистрировано, такую возможность в принципе исключить нельзя. В частности, в 1988 году в Калмыкии был отмечен по сравнению с 1987 годом подъем заболеваемости дизентерией, сальмонеллезами, вирусными гепатитами. На этом фоне в лечебных учреждениях Элисты произошла вспышка ВИЧ-инфекции. Одновременно был отмечен рост детской смертности от ЦМВИ: если в 1985 году она составила 8,7%, то в 1988 году – 21,4%. В 1985 году было 50% генерализованных форм ЦМВИ, в 1988 году – 76,6% [Л. Б. Кистенева, 2003].
На распространенность ЦМВИ влияют не только возраст человека, но и социально-экономические условия, а также расовая принадлежность. По данным ученых США, специфические ЦМВ-антитела в крови определяются у 10 – 20% детей, у 40% лиц до 35 лет и у 99% - старше 50 лет. В странах с низким социально-экономическим уровнем поголовное инфицирование населения происходит в более раннем возрасте. Вскоре после рождения оказываются инфицированными от 3 до 5% детей, после посещения школы – от 40 до 80% [В. И. Кулаков et al., 2001]. Доля ЦМВ-серопозитивных детей дошкольного возраста в африканских странах и странах южной части Тихого океана приблизительно составляет 80%, в то время как у детей из определенных слоев населения в западно-европейских странах и некоторых странах США, а также в Германии она равна только 20-40% [К. Фризе et al., 2003]. Аналогичные данные получены и отечественными исследователями: в группах с низким социально-экономическим уровнем жизни 40-60% лиц инфицируются в возрасте моложе 5 лет [Н. В. Каражас, 1997]. Что касается расовой принадлежности, то у коренных жительниц Лондона частота инфицированности составляет 3,1%, в то время как у эмигранток из Азии – 8,7%. Также отмечен высокий уровень ЦМВИ у лиц негроидной расы [В. И. Кулаков et al., 2001]. Как показывает проведенное в США в течение 11 лет проспективное исследование, наивысший риск появления на свет детей с врожденной ЦМВИ отмечается у цветных и белокожих матерей в возрасте 14-20 лет из низких социальных слоев. Последние заражаются первично главным образом в результате полового сношения, в то время как беременные женщины из средних и высших слоев общества в первый раз инфицируются в возрасте 20-30 лет посредством контакта с детьми грудного и младшего возраста, выделяющими вирус [К. Фризе et al., 2003].
ЦМВИ, как уже было упомянуто, относится к оппортунистическим инфекциям: клинически манифестированные формы ЦМВИ развиваются у лиц с ИДС (особенно при СПИДе), а также у новорожденных в связи с возрастными особенностями противовирусного иммунитета, в особенности у недоношенных [Е. А. Григорьева et al., 2003; В. И. Кулаков et al., 2001]. Кроме того, манифестация ЦМВИ происходит у онкологических больных, при лучевой болезни, тяжелой ожоговой травме [Л. Б. Кистенева, 2003]. Физиологическая иммунодепрессия при беременности также создает предпосылки для возникновения или активации латентно протекающей цитомегалии [Е. А. Григорьева et al., 2003; А. М. Ожегов et al., 2001].
ЦМВИ считается одной из самых распространенных ассоциированных со СПИДом инфекций. У 95% больных СПИДом развивается острая симптоматическая ЦМВИ, приводящая к тяжелым нарушениям: у 37% - к слепоте на почве хориоретинита, у 42% - к слабоумию и другим неврологическим проявлениям. Из числа больных СПИДом 39% погибают от прогрессирующей ЦМВИ, из них 56% - от ассоциированной с ЦМВ пневмонии, 34% - от почечной недостаточности и неукротимого поноса. Во взаимоотношениях с ВИЧ ЦМВ может выступать в роли кофактора, причем репликация обоих вирусов в клетке усиливается, отягощая и ускоряя течение СПИДа [Н. В. Каражас, 1997].
Факторами риска в развитии внутриутробной ЦМВИ считаются предшествующие в анамнезе аборты, выкидыши, мертворождения, ранняя детская смертность, юный возраст матери или возраст старше 35 лет, наличие хронической патологии, осложненное течение настоящей беременности и родов.
ЦМВ-инфицированию, по некоторым данным, более подвержены женщины, страдающие хроническими воспалительными заболеваниями гениталий, имеющие частые ОРВИ и ангины в анамнезе [К. В. Орехов et al., 2004]. Изучение соматического анамнеза в обширном исследовании узбекских ученых показало, что 86,7 – 91,7% женщин с верифицированной ЦМВИ страдали различными экстрагенитальными заболеваниями, у 2/3 из них регистрировались частые ОРВИ [Д. Б. Асранкулова, 2003]. По данным отечественных исследователей, 19% обследованных первородящих женщин были серонегативными, в то время как среди женщин с отягощенным акушерско-гинекологическим анамнезом лишь 5,5% пациенток не имели антител к ЦМВ класса IgG [Л. Б. Кистенева et al., 2003].
Патологические изменения шейки матки, снижение защитных свойств цервикальной слизи, а также акушерские вмешательства и манипуляции повышают риск ЦМВ-инфицирования [В. Л. Тютюнник et al., 2002].
По данным Е. А. Григорьевой и др., 2003, к ухудшению состояния больных ЦМВИ приводили интеркуррентные заболевания, очередная по календарю прививок вакцинация, смена климатической зоны.
СОСТОЯНИЕ ИММУНИТЕТА
Исследования показали, что у пациентов с острой и хронической ЦМВИ отмечен дисбаланс показателей клеточного и гуморального иммунитета [Д. Б. Асранкулова et al., 2004]. Еще до открытия ВИЧ в 1981 году ЦМВ считался ведущим вирусным агентом, вызывающим иммунодефицитное состояние. И до сих пор считается, что по повреждающему действию на Т-клетки ЦМВ уступает только ВИЧ [К. В. Орехов et al., 2004]. Иммунорегуляторный индекс (соотношение Т4- и Т8-лимфоцитов) нарушается вследствие увеличения содержания СD8+ [Н. В. Каражас, 1997].
Депрессия CD4+ субпопуляции Т-лимфоцитов может быть следствием прямого избирательного действия ЦМВ на эти клетки или служить фоном, на котором происходит инфицирование ЦМВ. О преимущественном значении клеточного иммунитета при цитомегаловирусной инфекции свидетельствует тот факт, что дети с врожденным Т-клеточным иммунодефицитом не могут с ней справиться, а пациенты с дефицитом иммуноглобулинов, но с нормально функционирующей системой клеточного иммунитета выздоравливают [Д. Б. Асранкулова et al., 2004].
ЦМВ приводит к слабой индукции интерферона, обладает малой чувствительностью к его действию. Это несомненно является важным фактором, ведущим к хронизации инфекции [Л. Б. Кистенева, 2003].
Считается, что ЦМВ присуща способность вызывать депрессию практически всех звеньев иммунитета – кроме угнетения клеток-киллеров и продукции интерферона, ЦМВ может вызывать дисфункцию макрофагов, дефицит продукции интерлейкинов. Во внутриутробном периоде вирус может вызывать клональную элиминацию созревающих Т- и В-лимфоцитов, что нарушает развитие иммунного ответа на данный вирус. Преждевременная внутриутробная стимуляция иммунной системы может приводить к поликлональной активации В-лимфоцитов и формированию аутоантител и иммунных комплексов. Это является фоном для развития аутоиммунных и иммунокомплексных заболеваний [Т. И. Долгих et al., 2004].
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ КАРТИНЫ
Многообразие клинических проявлений заболевания обусловлено способностью ЦМВ реплицироваться практически во всех клетках организма: в лейкоцитах, в моноцитах, тканевых макрофагах, эндотелиальных клетках сосудов, эпителиальных, нервных клетках, а также в фибробластах [Н. В. Каражас, 1997]. При персистенции инфекции можно выделить две стадии – стадию продуктивной репликации, при которой происходит формирование зрелого инфекционного вириона с выделением в окружающую среду полноценного вирусного потомства в течение нескольких месяцев и даже лет, и латентную стадию, которая характеризуется отсутствием формирования зрелых вирионов. Обе стадии персистирующей инфекции не являются стабильными, в течение жизни человека сменяя одна другую, поэтому в популяции в любом возрастном периоде не менее 10% населения являются вирусовыделителями [С. А. Демидова et al., 1976; Л. Б. Кистенева, 2003].
Единой классификации цитомегаловирусной инфекции не существует, что связано с широчайшим спектром ее клинико-патогенетических вариантов. Деление ЦМВИ на локализованную форму, при которой инфицированы только слюнные железы, и генерализованную, когда поражаются внутренние органы, очень условно. А. П. Казанцев и Н. И. Попова (1980) предложили следующую классификацию:
1. Врожденная цитомегалия:
a. Острая форма.
b. Хроническая форма.
2. Приобретенная цитомегалия:
a. Латентная форма.
b. Острая форма.
1. Мононуклеозная форма.
2. Генерализованная форма.
Н. А. Фарбер в зависимости от сроков и механизма инфицирования разработал другую систематику:
1. Перинатальное инфицирование.
a. Пренатальное инфицирование:
i. выкидыши, мертворождения;
ii. пороки развития;
iii. врожденная цитомегаловирусная инфекция.
b. Интра- и постнатальное инфицирование:
i. острое инфекционное заболевание;
ii. латентное носительство, инаппарантные, субклинические формы хронической инфекции;
iii. реактивация инфекции.
2. Инфицирование через кровь, слюну, мочу, при сексуальном контакте.
a. Острое инфекционное заболевание.
b. Латентное носительство, инаппарантные, субклинические формы.
c. Реактивация инфекции [Л. Б. Кистенева, 2003].
Приобретенное ЦМВ-заболевание не укладывается в рамки какой-либо нозологической формы. Оно может протекать с лихорадкой, интоксикацией, слабостью, миалгией, лимфоаденопатией, сиалоаденитом, гепатитом, язвами желудочно-кишечного тракта, миокардитом.
О пренатальном инфицировании свидетельствует выявление симптомов заболевания с первых дней жизни ребенка. Характерны желтуха, гепатоспленомегалия, геморрагический синдром. Желтуха может быть обусловлена поражением печени (врожденные гепатиты и циррозы), атрезией желчных путей, а также повышенным гемолизом эритроцитов. Поражаются и другие органы и системы: легкие (интерстициальная пневмония), центральная нервная система (гидроцефалия, менингоэнцефалит), пищеварительная система (энтерит, колит, фиброз, поликистоз поджелудочной железы), почки (нефрит). Острая врожденная форма ЦМВИ, как правило, носит генерализованный характер, протекает тяжело, осложняется присоединением вторичных инфекций и часто заканчивается летально в первые недели жизни ребенка. Одним из характерных проявлений ЦМВИ при внутриутробном заражении служит синдром диссеминированного внутрисосудистого свертывания. Нарушения свертывающей и противосвертывающей систем у плода и новорожденного возникают на фоне неразвитости ретикулоэндотелиальной системы, связаны с неадекватностью васкуляризации на микроциркуляторном уровне и недостаточной способностью печени к компенсаторному синтезу факторов свертывания крови [Л. Б. Кистенева, 2003].
Однако приблизительно 90% всех новорожденных, инфицированных во время беременности, не имеют необычных симптомов. Только у 10% наблюдаются такие симптомы, как врожденные пороки, микроцефалия, внутричерепной кальциноз, хориоретинит, глухота, гидроцефалия, гепатоспленомегалия, тромбопения, желтуха, петехии. При этом по-прежнему неясно, в каких случаях у плода и новорожденных болезнь переходит в тяжелую форму [К. Фризе et al., 2003; Ю. Н. Воронцова et al., 2004].
Инкубационный период колеблется от 15 до 90 дней. При интранатальном и раннем постнатальном инфицировании клинические признаки болезни определяются чаще через 1-2 месяца после родов. Заболевание может протекать с изолированным поражением слюнных желез или с поражением внутренних органов. Выделяют, исходя из ведущего клинического синдрома, респираторную, церебральную, желудочно-кишечную, гепатобилиарную, почечную, гематологическую формы. Помимо перечисленных органов и систем, могут поражаться надпочечники, щитовидная железа, яички и яичники, глаза, кожный покров, тимус. Заболевание, как правило, носит длительный, рецидивирующий характер. Одна из особенностей ЦМВИ – отсроченный характер поражения ЦНС, снижение умственного развития к 5-6 годам жизни у 20-30% внутриутробно инфицированных детей [Л. Б. Кистенева, 2003]. Такое явление носит название "скрытого цитомегаловирусного синдрома". 95% таких детей относится к группе условно здоровых. У таких "здоровых" при рождении детей в отдаленном периоде могут выявляться неврологические расстройства: низкий коэффициент интеллектуального развития, нарушения в поведении, плохая успеваемость в школе, а также дефекты зрения, слуха, речи, хроническая патология печени. С бессимптомными формами инфекции связан синдром внезапной смерти у детей [К. В. Орехов et al., 2004].
Инфицирование детей старшего возраста и взрослых в большинстве случаев не приводит к развитию заболевания. Формируется бессимптомное вирусоносительство или субклиническая, инаппарантная форма хронической ЦМВИ. Манифестация заболевания происходит у лиц с дефектным иммунным статусом, как было сказано выше.
Острая приобретенная форма ЦМВИ имеет клиническое сходство с инфекционным мононуклеозом [Л. Б. Кистенева, 2003]. Например, через 2-8 недель после гемотрансфузии может развиться мононуклеозоподобный синдром, проявляющийся лихорадкой, поражением печени, гепатоспленомегалией, атипическим лимфоцитозом (атипические мононуклеары). Наблюдаются также интерстициальная пневмония, субклинический миокардит, энцефалиты, менингиты, тромбоцитопения, гемолитическая анемия, гепатит, нефрит, увеит [Н. В. Каражас, 1997].
Реактивация ЦМВИ приводит к широкому спектру патологических проявлений – от сиалоаденита со скудной клинической симптоматикой (увеличение слюнных желез, регионарный лимфаденит) до тяжелых диссеминированных форм. Чаще поражаются печень (цитомегаловирусный гепатит с холестатическим компонентом), легкие (интерстициальная пневмония), желудочно-кишечный тракт (эзофагит, энтероколит, в том числе язвенно-некротический). ЦМВ играет роль в развитии гинекологических заболеваний (цервицит, вульвовагинит, эндометрит, эрозии и рак шейки матки). При тяжелых генерализованных формах изменения носят полиорганный характер. Заболевание по клинической картине напоминает сепсис, сопровождается длительной лихорадкой, симптомами интоксикации, увеличением лимфатических узлов [Л. Б. Кистенева, 2003].
ДИАГНОСТИКА
По данным А. Г. Балазамах (1988), достоверность диагностики TORCH-инфекций и цитомегаловирусной инфекции в частности только по клиническим данным не превышает 10%. Поэтому диагноз ЦМВИ не может быть установлен без соответствующего лабораторного подтверждения [Л. Б. Кистенева et al., 2003].
Основанием для обследования ребенка на наличие инфекций должны быть: подозрение на наличие внутриутробной инфекции, поражение центральной нервной системы, полиорганные поражения, а также рождение детей от матерей, у которых во время беременности отмечались клинические и/или лабораторные признаки активации цитомегаловирусной инфекции [Т. И. Долгих et al., 2004].
По данным общего лабораторного обследования часто отмечаются тромбоцитопения, прямая гипербилирубинемия, повышение уровня аспартатаминотрансферазы. Изменения в крови неспецифичны, их характер целиком определяется формой повреждения: при поражении печени страдают печеночные пробы, при мононуклеозоподобной форме в анализе крови появляются атипичные мононуклеары [Л. Б. Кистенева, 2003; П. А. Самохин, 1987]. Кроме того, при микст-инфекции могут встречаться нетипичные для вирусных поражений проявления со стороны крови вплоть до лейкоцитоза (87%) и нейтрофилеза со сдвигом влево (56,3%) [Т. И. Долгих et al., 2004].
Структурной основой специфической диагностики является антигенная характеристика ЦМВ. Гликопротеиды внешней оболочки ЦМВ являются типоспецифическими антигенами, позволяющими дифференцировать отдельные серотипы вирусов герпеса в реакциях нейтрализации и иммунофлюоресценции. Гликопротеиды вызывают образование защитных, вируснейтрализующих антител. Белки нуклеокапсида в основном несут группоспецифические антигенные эпитопы, одинаковые для отдельных вирусов герпеса. Их выявляют в реакциях преципитации и иммунодиффузии [В. И. Кулаков et al., 2001].
Частота выявления вируса в крови значительно выше, чем в фарингеальных мазках и других средах, особенно в лейкоцитарной взвеси, а не в сыворотке крови [О. Ю. Манзенюк et al., 2003].
Среди лабораторных методов с целью специфической диагностики ЦМВИ в нашей стране наиболее часто применяются полимеразная цепная реакция и определение специфических антител. В то же время золотым стандартом для диагностики ЦМВИ является культуральный метод [Ю. Н. Воронцова et al., 2004]. Недостатком этого высокочувствительного в отношении ЦМВ метода является длительность исполнения, так как вследствие медленного развития цитопатического эффекта методика культивирования вируса требует 2-3 недели для получения окончательного результата. Еще одним безусловным недостатком этого метода является его высокая стоимость [Л. Б. Кистенева et al., 2003]. В последние годы в клиническую практику активно внедряется его модификация – быстрый культуральный метод. При этом прослеживается зависимость между отрицательными результатами ПЦР и положительными результатами быстрого культурального метода: в большинстве случаев отрицательные результаты ПЦР наблюдались при минимальном количестве инфекционно активного вируса в крови и в моче, в то время как быстрый культуральный метод давал положительные ответы даже в этом случае [Ю. Н. Воронцова et al., 2004]. В основе метода лежит выявление вирусоспецифических антигенов с помощью гипериммунной сыворотки или моноклональных антител в клеточной культуре, зараженной материалом, полученным от больного: ЦМВ индуцирует синтез предраннего или раннего антигена в ядрах клеток-фибробластов. Ограничением для применения данной методики является необходимость наличия специального оборудования и свежеприготовленного монослоя фибробластов; результат может быть получен уже через 24 часа [Л. Б. Кистенева et al., 2003].
Антитела формируются в среднем через 17 дней после появления симптомов ЦМВИ и персистируют в организме 2-3 месяца [Н. В. Каражас, 1997].
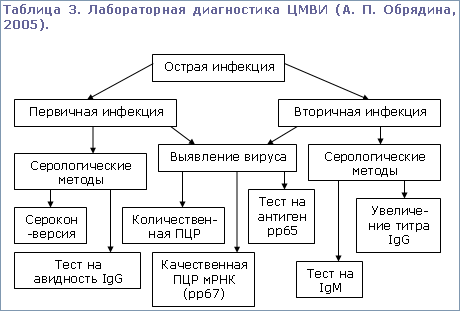
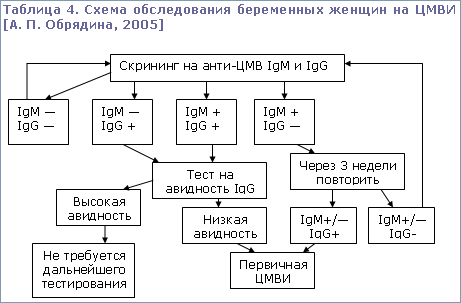
Исследователи отмечают, что диагностическая ценность рутинных серологических методов, основанных на оценке гуморального иммунитета к ЦМВ (определение антител к ЦМВ классов IgM и IgG), особенно в период ранней неонатальной адаптации является низкой. Установлено, что для новорожденных и детей первых трех месяцев жизни характерны низкие и средние уровни специфических антител класса IgG (1 : 100 – 1 : 1600), что, очевидно, связано с наличием материнских антител, полученных ребенком трансплацентарно. Проспективные исследования, проведенные с целью выявления активной ЦМВИ, свидетельствуют о том, что у детей первого года жизни ЦМВ-IgM детектируются лишь в 8,4% случаев, а у новорожденных – в 5,1% случаев. Далее, оказалось, что в возрасте 1-3 месяца и 4-6 месяцев на фоне исчезновения материнских антител соответственно чаще в 1,5 раза и в 3 раза выявлялись IgM. Во втором полугодии жизни ЦМВ-IgM обнаруживались в 3,9 раза чаще, чем в первом полугодии жизни [Т. И. Долгих et al., 2004].
Кроме того, недостатком ИФ-метода определения антител является то, что он может быть положительным при инфекции, вызванной другими вирусами семейства Herpesviridae – вирусом Эпштейна-Барр и вирусом герпеса типа 3 (Varicella-Zoster). IgM-тест в ряде случаев является ложноположительным, например, у больных с коллагенозами, поскольку ревматоидный фактор, будучи IgM-антителом по отношению к IgG, определяется у таких пациентов в большом количестве.
Использование специальных серологических методов (иммуноблоттинг, авидность) дает дополнительную информацию, но лишь в некоторых случаях позволяет оценить прогноз развития инфекционного процесса [Ю. Н. Воронцова et al., 2004]. С помощью иммунного блоттинга можно точно оценить соотношение между анти-ЦМВ разных классов. Метод определения авидности анти-ЦМВ антител позволяет выявить текущую или недавно перенесенную ЦМВИ.
Доказательством внутриутробной инфекции является выделение ЦМВ или ЦМВ-антигена в первые 2-4 недели жизни. Первое выявление ЦМВ в материале, полученном позже четырехнедельного возраста, может являться свидетельством не только пренатальной, но и постнатальной инфекции [К. В. Орехов et al., 2004].
По мнению некоторых исследователей, высокий титр анти-ЦМВ-антител у беременных имеет неблагоприятное прогностическое значение для плода, однако другие авторы считают, что такие антитела, проникая через плаценту, защищают его от инфицирования [Д. Б. Асранкулова et al., 2004; В. М. Сидельникова et al., 1996].
Для повышения надежности клинико-лабораторной диагностики данного заболевания большинством ученых рекомендуется соблюдение следующих условий:
1. использование двух методов диагностики для обнаружения прямых маркеров ЦМВ (быстрого культурального метода и ПЦР);
2. исследование двух биологических жидкостей (кровь, моча) от одного пациента;
3. повторное обследование в обязательном порядке пациентов из группы риска независимо от результатов первичного анализа [Ю. Н. Воронцова et al., 2004].
По данным С. А. Демидовой (1976), морфологический метод – обнаружение клеток-цитомегалов при гистологических исследованиях материалов от больных (слюна, моча, грудное молоко etc.), материалов аутопсии и биоптатов паренхиматозных органов - позволяет диагностировать ЦМВИ лишь в 50% случаев, а отсутствие цитомегалических включений не исключает наличия инфекции [Л. Б. Кистенева et al., 2003].
Для пренатальной диагностики ЦМВИ применяют комбинацию серийного ультразвукового сканирования, специфического (с выявлением антител IgG и IgM, вирусной ДНК) анализа амниотической жидкости, материнской и фетальной крови (взятой при кордоцентезе) [В. И. Кулаков et al., 2001]. По данным американских авторов при массовом скрининговом ультразвуковом исследовании плода обнаружение эхогенных фокусов в легких плода является достаточно редкой находкой, а в случае обнаружения они расцениваются как прогностически неблагоприятные (беременность при этом заканчивалась прерыванием, патологией внутриутробного развития) [Л. Б. Кистенева, 2003]. Кроме петрификатов в легких и паренхиматозных органах, перивентрикулярного кальциноза, УЗИ позволяет выявить синдром "инфекции околоплодных вод" и плацентарную недостаточность [В. И. Кулаков et al., 2001]. Далее, выявленные уже в первые сутки жизни по данным ультразвукового исследования головного мозга порэнцефалия, кальцификаты в перивентрикулярной зоне, небольшие очаги высокой эхоплотности в области базальных ганглиев, сравнимые с эхоплотностью костей черепа, субэпендимальные псевдокисты также свидетельствуют о внутриутробном инфекционном поражении ЦНС [Л. Б. Кистенева, 2003].
Некоторые авторы сообщают, что в качестве мониторинга ЦМВИ целесообразно исследовать мочу на наличие антигена / ДНК вируса в качестве отборочного теста [Т. И. Долгих et al., 2004].
ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Выздоровление констатируется при отсутствии клинической симптоматики и стойких отрицательных результатах исследования на антигены ЦМВ в крови и моче, антитела к ЦМВ класса IgM. Пациенты с острым и затяжным течением ЦМВИ должны наблюдаться в течение года, с хроническим – в течение 3 лет после клинико-лабораторной ремиссии. При резидуальной форме наблюдение осуществляется длительно. Кратность осмотров: через 1, 3, 6, 12 месяцев, в дальнейшем через каждые 6 месяцев после выписки из стационара. В указанные сроки проводится обследование на активную ЦМВИ: выявление антигенов вируса в крови, моче, слюне, серологическое обследование (выявление специфических к ЦМВ IgG, IgM, IgA). Проводится оценка гематологических показателей, биохимические тесты, иммунологическое обследование, неврологическое и аудиологическое обследование, УЗИ головного мозга и паренхиматозных органов. В периоде реконвалесценции проводится терапия, направленная на восстановление функционального состояния поврежденных органов и регуляцию иммунитета [К. В. Орехов et al., 2004].
НЕСПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА
Профилактика экспозиции ЦМВ едва ли возможна из-за различных путей передачи и скудной симптоматики [А. Туки et al., 2000].
Поэтому прежде всего неспецифическая профилактика предусматривает выявление серонегативных планирующих беременность либо уже беременных женщин. Внимание последних нужно привлечь к необходимости тщательного соблюдения норм гигиены, в том числе при половом акте, избегания контактов с часто болеющими ЦМВИ группами (маленькими детьми), соблюдать осторожность при работе в детских яслях etc. Речь идет об установлении ЦМВ-иммуностатуса полового партнера, о гигиенических мероприятиях после смены пеленок или после прикосновения к игрушкам, испачканным слюной, а также об отказе от поцелуев в губы детей грудного возраста, которые могут выделять вирус [К. Фризе et al., 2003; А. Туки et al., 2000].
Серонегативным женщинам с маленькими детьми, которые обращали внимание на соблюдение упомянутых выше правил, профилактика экспозиции оказалась эффективной [К. Фризе et al., 2003].
В случае развития ЦМВИ у серопозитивной лактирующей женщины грудное кормление ее ребенка не должно прекращаться, так как при грудном вскармливании ребенок получает с молоком анти-ЦМВ-антитела [К. В. Орехов et al., 2004].
Кроме того, невозможно переоценить значение исследований крови и органов на ЦМВ, что считается настолько же важным, как и проводимые в настоящее время проверки на ВИЧ, гепатит и сифилис [Н. В. Каражас, 1997].
СПЕЦИФИЧЕСКАЯ ПАССИВНАЯ ПРОФИЛАКТИКА И СПЕЦИФИЧЕСКОЕ ЛЕЧЕНИЕ
Вследствие широкого распространения ЦМВИ абсолютное большинство доноров содержат в крови антитела к ЦМВ. Это служит основанием для использования иммуноглобулинов в профилактике и лечении активной ЦМВИ. Препараты иммуноглобулинов оказывают иммуномодулирующее и антитоксическое действие, активизируют опсонофагоцитарные реакции [Л. Б. Кистенева, 2003].
Для пассивной иммунизации существуют различные препараты гипериммуноглобулина с известным содержанием нейтрализующих антител, а также специфическая гипериммунная плазма. Их назначают главным образом профилактически ЦМВ-негативным реципиентам перед трансфузией и трансплантацией либо с терапевтической целью в сочетании с ганцикловиром пациентам с иммуносупрессией, а также недоношенным с ЦМВ-симптоматикой. Серонегативной беременной, особенно после профессионального контакта с больным, надо подумать о применении гипериммуноглобулина. Значение этой меры для предотвращения ЦМВИ до сих пор не оценено [К. Фризе et al., 2003, К. И. Григорьев, 2004].
При лечении активной цитомегаловирусной инфекции широко используется Цитотект, нормальный человеческий иммуноглобулин для внутривенного применения с повышенным содержанием антител к цитомегаловирусу. Стоимость цитотекта высока.
Для лечения активной цитомегаловирусной инфекции целесообразно использовать серии отечественного нормального человеческого иммуноглобулина с высоким титром антител к цитомегаловирусу (в иммуноферментном анализе 1 : 640 000).
Препараты иммуноглобулина противопоказаны больным с повышенной чувствительностью к иммуноглобулину человека [Л. Б. Кистенева, 2003].
СПЕЦИФИЧЕСКАЯ АКТИВНАЯ ПРОФИЛАКТИКА
Разработаны два вида вакцин – аттенуированная живая HCMV-вакцина Towne 125 и вакцина субъединичного гликопротеина В, которые в настоящее время проходят испытания в целях введения их больным – реципиентам трансплантируемых органов; у этих пациентов после курса иммуносупрессивной терапии возникает риск массивного ЦМВ-инфицирования [А. Туки et al., 2000; К. Фризе et al., 2003].
Экспериментально Yow и Demmler удалось разработать вакцину для серонегативных женщин репродуктивного возраста [К. Фризе et al., 2003]. Однако маловероятно, что живая вакцина может быть пригодной для профилактики врожденной инфекции. Существует опасность возможной реактивации инфекции, вызванной вакциной, в период беременности, а также вероятного онкогенного действия вакцины [А. Туки et al., 2000]. Тем не менее рассчитано, что рутинная вакцинация всех женщин в возрасте 15-25 лет и выборочная вакцинация неиммунных женщин этой возрастной группы в популяциях с низкой или средней распространенностью ЦМВИ является экономически эффективной [К. Фризе et al., 2003].
При создании вакцины из отдельных функциональных частей генома ЦМВ должен быть решен вопрос о группах наиболее активных "целевых" частиц генома [А. Туки et al., 2000].
СПИСОК СОКРАЩЕНИЙ
P. carinii – Pneumocystis carinii
pH – кислотность
ВОЗ – Всемирная Организация Здравоохранения
ДНК – дезоксирибонуклеиновая кислота
ИДС – иммунодефицитное состояние
ИФ - иммунофлюоресценция
ИФА – иммуноферментный анализ
ПЦР – полимеразная цепная реакция
РИФ – реакция иммунофлюоресценции
СПИД – синдром приобретенного иммунодефицита
УЗИ – ультразвуковое обследование
ХОБЛ – хронические обструктивные болезни легких
ЦНС – центральная нервная система
ЦМВ - цитомегаловирус
ЦМВИ – цитомегаловирусная инфекция
СПИСОК ЛИТЕРАТУРЫ
1. Д. Б. Асранкулова Эпидемиологические особенности цитомегаловирусной инфекции среди различных контингентов населения Узбекистана. – в: Эпидемиология и инфекционные болезни, №3, 2003, с. 19-21.
2. Д. Б. Асранкулова, А. П. Ризопулу, Д. Д. Курбанов Иммунный статус и провоспалительные цитокины у беременных с острой цитомегаловирусной инфекцией. – в: Журнал микробиологии, эпидемиологии и иммунобиологии, №4, 2004, с. 84.
3. Ю. И. Барашнев Перинатальная неврология. М., Триада-Х, 2001. – 640 с.
4. Е. И. Боровкова, И. С. Сидорова et al. Факторы и условия, влияющие на процесс инфицирования плода на разных сроках беременности. – в: Вестник Российской Академии Медицинских Наук, №1, 2004, с. 48-50.
5. Ю. Н. Воронцова, Н. Н. Володин et al. Сравнительный анализ клинических и лабораторных характеристик врожденной цитомегаловирусной инфекции у недоношенных детей. – в: Российский вестник перинатологии и педиатрии, №2, 2004, с. 60-65.
6. К. И. Григорьев Внутриутробные и неонатальные инфекции. – в: Медицинская помощь, №5, 2004, с. 7-15.
7. Е. А. Григорьева, И. А. Московская et al. Перинатальная цитомегаловирусная инфекция (клинико-лабораторные параллели). – в: Эпидемиология и инфекционные болезни, №1, 2003, с. 40-42.
8. С. А. Демидова, Е. И. Семенова et al. Цитомегаловирусная инфекция человека. М., Медицина, 1976. – 167 с.
9. Т. И. Долгих, Е. А. Гашина et al. Герпетическая и цитомегаловирусная инфекции у детей первого года жизни: оптимизация диагностики и лечения. – в: Вестник Уральской Медицинской Академии Наук, №4, 2004, с. 24.
10. Т. И. Долгих, В. В. Далматов et al. Эпидемиологические аспекты цитомегаловирусной инфекции у детей первого года жизни. – в: Журнал микробиологии, эпидемиологии и иммунобиологии, №5, 2004, с. 25-30.
11. Н. В. Каражас Цитомегаловирусная инфекция – типичный представитель оппортунистических инфекций. – в: Российские медицинские вести, №2, 1997, с. 34-38.
12. Л. Б. Кистенева Цитомегаловирусная инфекция как проблема перинатальной патологии: классификация, клинические проявления, дифференциальный диагноз, лечение, профилактика. – в: Российский вестник перинатологии и педиатрии, №5, 2003, с. 52-56.
13. Л. Б. Кистенева, К. А. Мартынов et al. Цитомегаловирусная инфекция у беременных. Диагностика, трактовка результатов обследования. – в: Вопросы вирусологии, №6, 2003, с. 4-7.
14. В. И. Кулаков, Б. Л. Гуртовой et al. Цитомегаловирусная инфекция в акушерстве. М., Гэотар-мед, 2001. – 32 с.
15. О. Ю. Манзенюк, О. В. Москалец Цитомегаловирусная инфекция у детей с различной инфекционно-воспалительной патологией. – в: Медицинская иммунология, №3/4, 2003, с. 305-306.
16. Л. Л. Нисевич et al. Значение различных вирусных инфекций в невынашивании, мертворождении, перинатальной и младенческой смерти. – в: Педиатрия, №1, 1999. – с. 4.
17. А. П. Обрядина Диагностика герпес-вирусных инфекций. Материалы семинара НПО "Диагностические системы", Ростов-на-Дону, НИИАП, 2005.
18. А. М. Ожегов, С. В. Мальцев, Л. С. Мякишев Клинико-иммунологическая характеристика активной цитомегаловирусной инфекции и сочетанной с ней инфекции у детей первого года жизни. – в: Педиатрия, №2, 2001, с. 26.
19. К. В. Орехов, М. В. Голубева, Л. Ю. Барычева Врожденная цитомегаловирусная инфекция. – в: Детские инфекции, №1, 2004, с. 49.
20. В. М. Сидельникова, Д. Г. Дадальян et al. Цитомегаловирусная инфекция у пациенток с привычным невынашиванием беременности. – в: Акушерство и гинекология, №4, 1996, с. 21.
21. А. Туки, С. Пекхем et al. Врожденные, перинатальные и неонатальные инфекции. М., Медицина, 2000. - 288 с.
22. В. Л. Тютюнник, Н. В. Орджоникидзе et al. Перинатальные аспекты цитомегаловирусной инфекции. – в: Акушерство и гинекология, №1, 2002, с. 9-11.
23. К. Фризе, В. Кахель Инфекционные заболевания беременных и новорожденных. М., Медицина, 2003. – 424 с.
|



